
Nat Methods | 北京大学临床医学高等研究院黄小帅团队与合作者开发4Pi-SIM超分辨率成像技术实现活细胞双色三维各向同性100纳米分辨率
Nat Methods | 北京大学临床医学高等研究院黄小帅团队与合作者开发4Pi-SIM超分辨率成像技术,实现活细胞双色三维各向同性100纳米分辨率。
近日,由西湖大学章永登团队与北京大学黄小帅团队、重庆邮电大学范骏超团队、北京大学陈良怡团队合作的研究成果发表在《Nature Methods》杂志上,标题为《Elucidating subcellular architecture and dynamics at isotropic 100 nm resolution with 4Pi-SIM》。该研究突破性地开发了一种新型4Pi-SIM超分辨显微镜架构,在活细胞中实现了三维各向同性100纳米分辨率的动态延时成像。

突破背景:从模糊到清晰
细胞中的亚细胞器具有精细的三维结构和生物学功能,利用荧光显微镜观察细胞器的三维分布和动态有助于了解细胞功能和揭示细胞器之间的相互作用。但传统荧光显微镜受限于光学衍射极限和物镜数值孔径(NA),只能提供低分辨率图像,难以揭示细胞器之间的动态交互。尽管近年来陆续出现超分辨成像技术,例如受激发射损耗成像技术(STED)、单分子定位成像技术(SMLM)以及结构光照明成像技术(SIM),但这些技术多受制于固定样品或成像速度不足。
因此,在活细胞上实现三维各向同性分辨率的快速超分辨成像,仍然是细胞生物学领域长期梦寐以求的目标。
创新亮点:4Pi-SIM的核心技术
本研究提出了一种新型4Pi-SIM超分辨显微镜架构,以三维各向同性100 纳米分辨率揭示了不同类型细胞中复杂精细的亚细胞结构。4Pi-SIM首次在活细胞上实现了三维各向同性100纳米光学分辨率延时成像,成像时程可达数小时(500-600个时间点)。另外,4Pi-SIM还具备同时双色成像能力,能够捕捉三维空间内不同细胞器之间的快速相互作用过程。该研究也将在Nature Methods上发表题为Isotropic 100 nm resolution live-cell imaging with 4Pi-SIM的研究简报 (Research Briefing) 。
该团队基于4Pi单分子超分辨显微镜和海森结构光照明显微镜的研究经验,对4Pi-SIM显微镜的光学结构和机械结构进行了精心设计(图1),最大程度地降低了热波动和机械振动的影响,确保了六束光干涉对齐和荧光干涉的长期稳定性;通过引入锁焦模块,系统能够保证两个物镜精确对齐;通过设计光程差调节模块,系统能够快速、精确地将上下干涉臂的光程差微调至零;此外,系统采用新颖的I2M照明模块,并改进了重建算法,自适应地估计和补偿原始数据中系统光程差不匹配导致的相位误差,从而最大限度地减少长时程成像时的重建伪影。
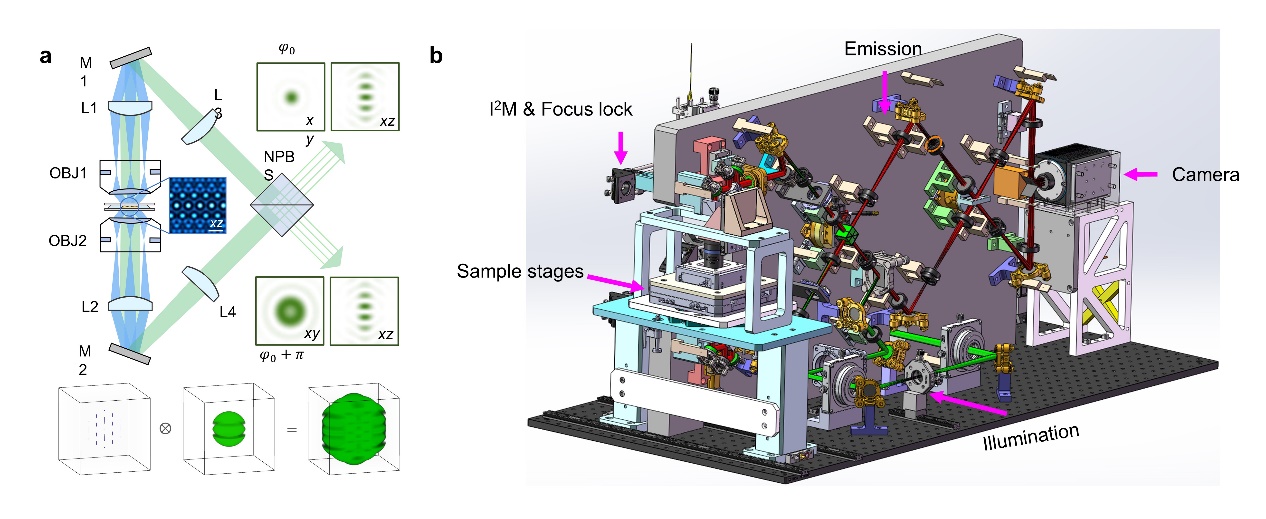
图1:4Pi-SIM超分辨显微镜的原理图和系统设计图。a,4Pi-SIM系统原理图。b,4Pi-SIM系统设计图。
上述改进使4Pi-SIM能够在三维空间内以极佳的清晰度和细节捕捉观察各种亚细胞结构。例如,研究团队利用4Pi-SIM成功展示了小鼠精母细胞中联会复合体的双螺旋结构。而3D-SIM由于轴向分辨率不足,在轴向视野中错误地合并了两条染色体结构(图2a-c)。此外,研究团队还利用4Pi-SIM观察了固定HeLa细胞的细胞膜结构。细胞膜通常在表面形成许多直径为100-300纳米的丝状伪足。4Pi-SIM可以清晰地分辨出这些丝状伪足在横向和轴向的中空结构。相比之下,3D-SIM的轴向视图中无法分辨丝状伪足的细节特征(图2d-e)。
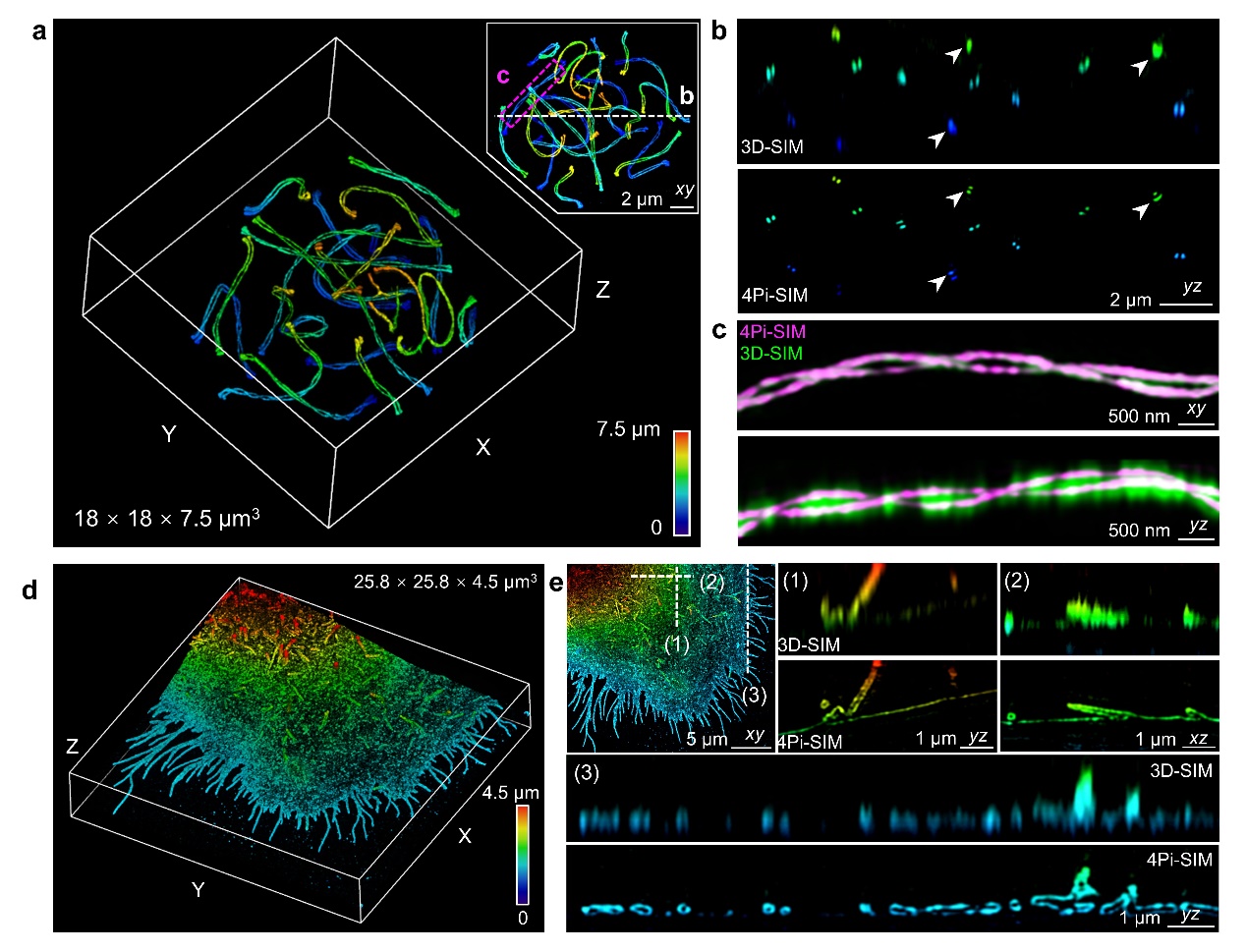
图2:4Pi-SIM用于固定细胞三维超分辨成像。a-c,小鼠精母细胞免疫荧光标记联会复合体的4Pi-SIM成像。d-e,HeLa细胞免疫荧光标记细胞质膜的4Pi-SIM成像。
长时程成像实验需要保证4Pi-SIM中干涉腔的长期稳定性,并在重建算法中对成像过程中系统光程差的漂移进行补偿。因此,活细胞成像相对于固定细胞而言更加具有挑战性。研究团队利用4Pi-SIM对标记线粒体外膜的HeLa细胞进行延时成像,重建图像展现出清晰的中空结构,并捕捉到了线粒体的动态行为(图3a-b)。在一个区域,研究团队观察到棒状线粒体转变为类似凹盘的结构(图3c);在另一个区域,则观察到管状线粒体从两端生成纳米管道,其直径从约600纳米减小到150纳米(图3d)。
内质网具有错综复杂的三维网络结构,并在活细胞内表现出显著的动态特性。借助4Pi-SIM的超高时空分辨率,研究团队在COS-7细胞中观察到内质网的快速重组,并捕捉到管状内质网逐渐形成片状内质网的过程(图3e-g)。

图3:4Pi-SIM用于活细胞快速三维超分辨成像。a-d,HeLa细胞中线粒体的4Pi-SIM动态成像。e-g,COS-7细胞中内质网的4Pi-SIM动态成像。
多色成像对于研究三维空间中相邻细胞器之间的动态相互作用至关重要。研究团队使用光稳定性好的绿色荧光蛋白StayGold和一种大斯托克斯位移的荧光蛋白(dCyOFP2s)标记样本,在单色激发波长下实现了同时采集双色荧光信号的活细胞成像。通过在活细胞中同时标记内质网和线粒体,研究团队观察了内质网-线粒体的相互作用(图4a-b),并捕捉到线粒体在两个细胞器的接触点发生了融合和分裂事件(图4c-d)。此外,研究团队在活细胞中同时标记内质网和线粒体,观察到内质网管状网络和微管错综复杂地交织在一起,形成了横跨细胞质的动态互连(图4e-f)。这些快速的相互作用促进了两种细胞器的重新排列(图4g-h)。
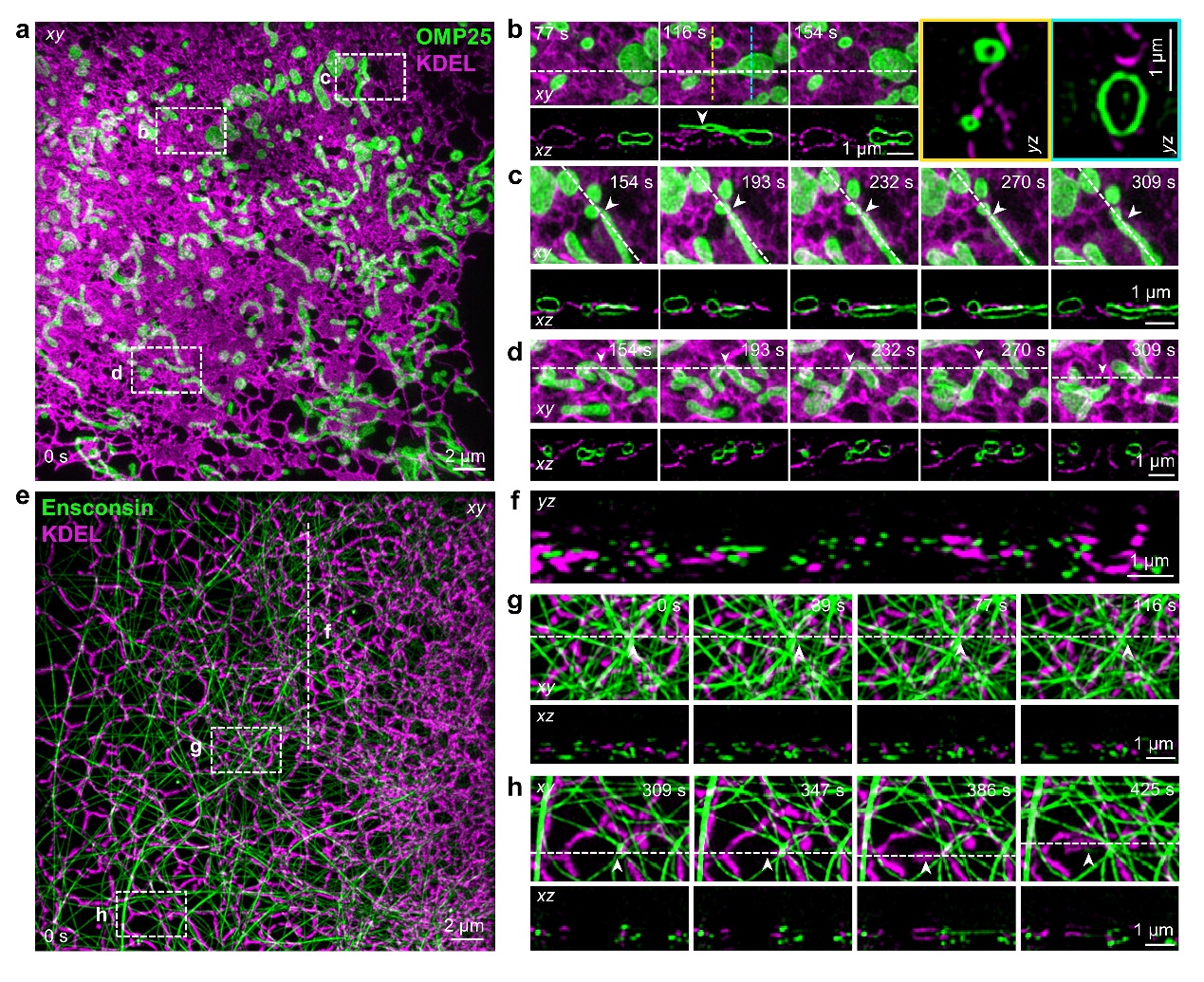
图4:4Pi-SIM同时双色成像。a-d,HeLa细胞中内质网(品红色)和线粒体(绿色)的双色4Pi-SIM动态成像。e-h,COS-7细胞中内质网(品红色)和微管(绿色)的双色4Pi-SIM动态成像。
未来展望:生物学研究的新引擎
4Pi-SIM显微镜是活细胞三维超分辨成像领域的重要进展,为细胞生物学提供了全新观察视角。正如Marcel Proust所言: "The real voyage of discovery consists not in seeking new landscapes, but in having new eyes." 4Pi-SIM显微镜在阐明纳米尺度的亚细胞精细结构和动态行为等方面具有重要潜力,有望为细胞生物学的发展提供新的观察视角和研究思路。
西湖大学章永登研究员、北京大学黄小帅研究员、重庆邮电大学范骏超副教授和北京大学陈良怡教授为该论文共同通讯作者,北京大学博士生欧阳子婧、西湖大学博士生王倩和北京大学博士生李晓雨为该论文共同第一作者。此外,该工作也得到了耶鲁大学邵林博士、西湖大学俞晓春课题组、刘长亮课题组的重要支持和帮助。该研究得到国家自然科学基金、国家科技部重点研发计划、浙江省“尖兵”&“领雁”项目、西湖实验室、西湖大学未来产业研究中心和西湖教育基金会提供的经费支持。
原文链接:https://www.nature.com/articles/s41592-024-02515-z
北京大学黄小帅课题组(https://iacm.bjmu.edu.cn/)拟招聘2-3名博士后,欢迎拥有生物医学工程、物理光学、图像处理等背景的申请者加入;招聘1名科员助理,欢迎生物学背景的申请者加入。有意者请将个人简历发送至(hxs@hsc.pku.edu.cn)。
