
跨学部生物医学工程系
张名姝
邮箱:mszhang@hsc.pku.edu.cn
地址:北京市海淀区学院路38号
个人简介
国家优秀青年科学基金、首届青年人才托举工程、中科院青年创新促进会优秀会员和卢嘉锡青年人才奖获得者。本科和博士分别毕业于北京航空航天大学和中科院生物物理研究所,在美国HHMI Janelia Research Campus完成访问学者研究。长期致力于新型荧光探针的开发及其在超分辨、活细胞深层、双模态显微成像中的应用。研究成果发表在Nature Methods(2篇)、Cell Research、Nano Letters、PNAS(2篇)等期刊。任Biophysics Reports青年编委。
主要研究方向
1. 高空间分辨率成像探针
研究光控荧光探针性能调控新规律和新途径,建立超分辨荧光探针开发普适性策略。前期工作分别为单分子定位成像(PALM)和光激活非线性结构光照明成像(PA NL-SIM)发展金标准探针mEos3.2和Skylan-NS,前者解决已有探针实际分辨率低且无法标记膜蛋白的应用局限,后者结合新型成像仪器突破性提升结构光照明成像的空间分辨率。
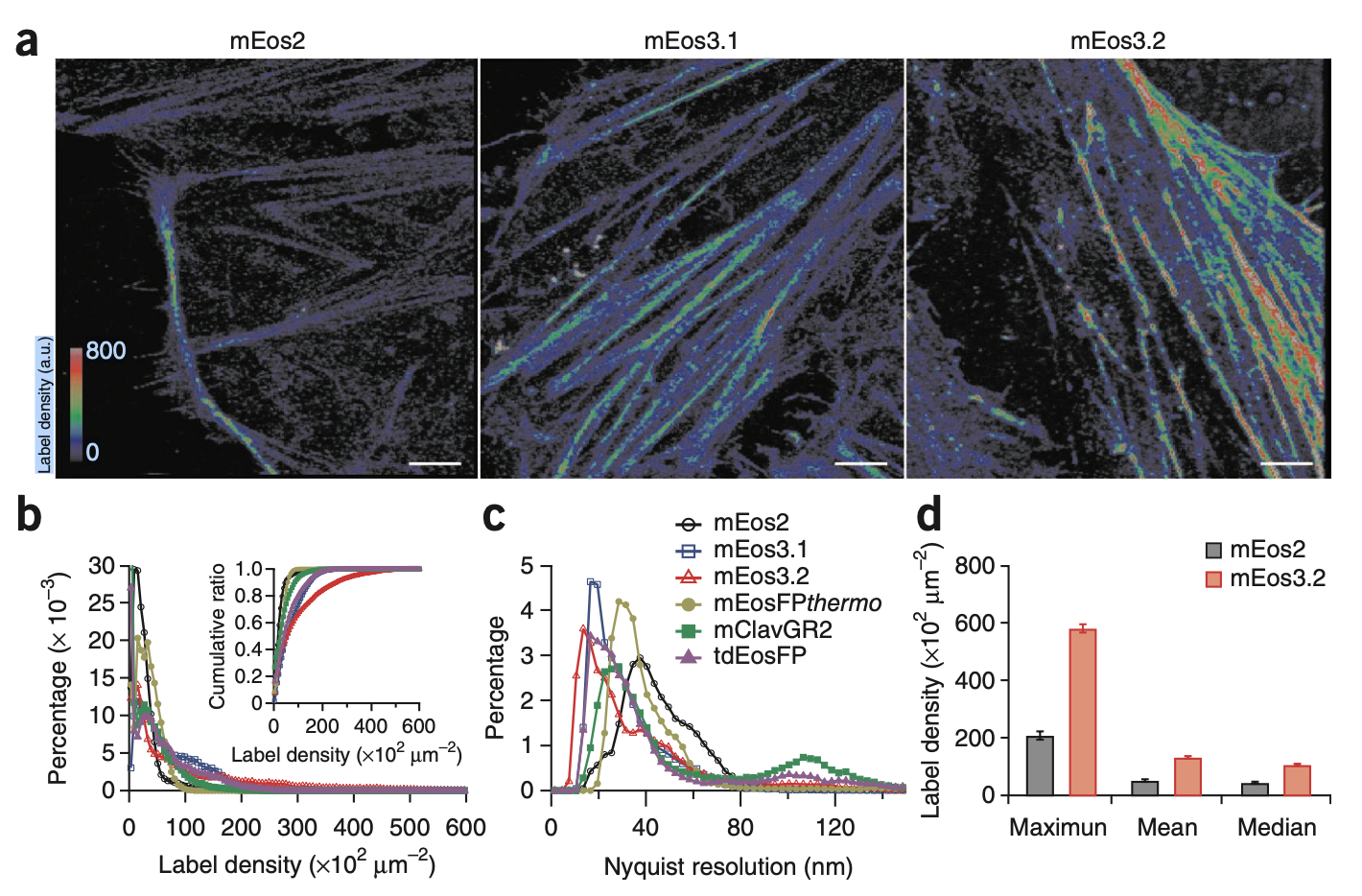
图1: mEos3.2提高单分子定位成像分辨率。(a) mEos2、mEos3.1和mEos3.2标记Hela细胞Lifeact的PALM图像示例。(b)不同光转化荧光蛋白标签密度分布及其累积分布比。(c)图(b)计算得到的Nyquist分辨率分布。(d) mEos2和mEos3.2标签密度对比。
2. 活细胞超分辨成像探针
研发高时间分辨率超分辨成像探针和配套算法,实现活细胞内更小尺度、更快运动靶标的精准定位和示踪。前期工作利用光转化荧光蛋白的独特光物理性质,设计发展了成像设备简单、兼具高时/空分辨率(0.5-2 s/50 nm)的超分辨成像算法SIMBA。在此基础上,发展具有更高光转化效率和标记密度的成像探针pcStar和配套算法Quick-SIMBA,将活细胞单分子定位成像的时/空分辨率推进至0.1 s/50 nm,证实细胞内“密集管状内质网”结构往往由于时空分辨率不足被误认为成“片状内质网”。
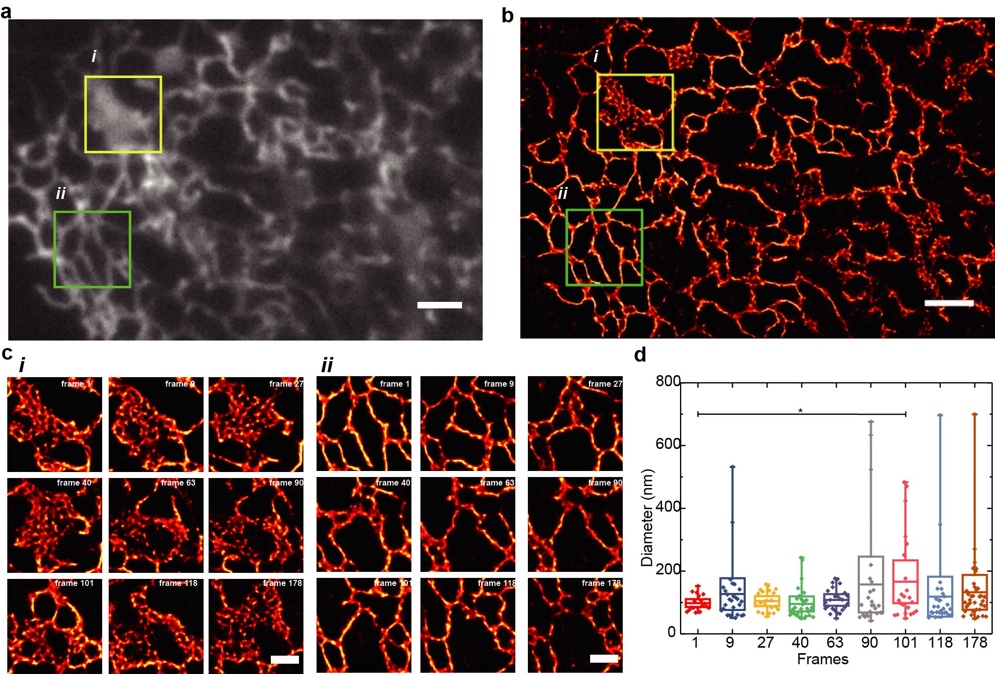
图2:Quick-SIMBA超分辨追踪COS-7细胞内质网动态结构。(a)由50张原始图叠加而成的宽场图。(b) Quick-SIMBA超分辨重构图。(c)图(b)中方形区域在图示时间点的放大图。(d)图(ci)中管状内质网间距统计。
3. 光电关联超分辨成像探针
发展光镜-电镜双模态兼容的超分辨荧光成像探针,解决光电关联成像标记和精确配准难题。前期工作开发了第一个耐常规电镜制样的光控荧光探针mEosEM,首次实现疏水树脂包埋后同层切片的高精度超分辨光电关联成像。在此基础上,设计和发展二代双色成像探针和去背景成像方法,推动常温超分辨光电关联成像向大尺度三维(如脑组织)和双色方向发展。
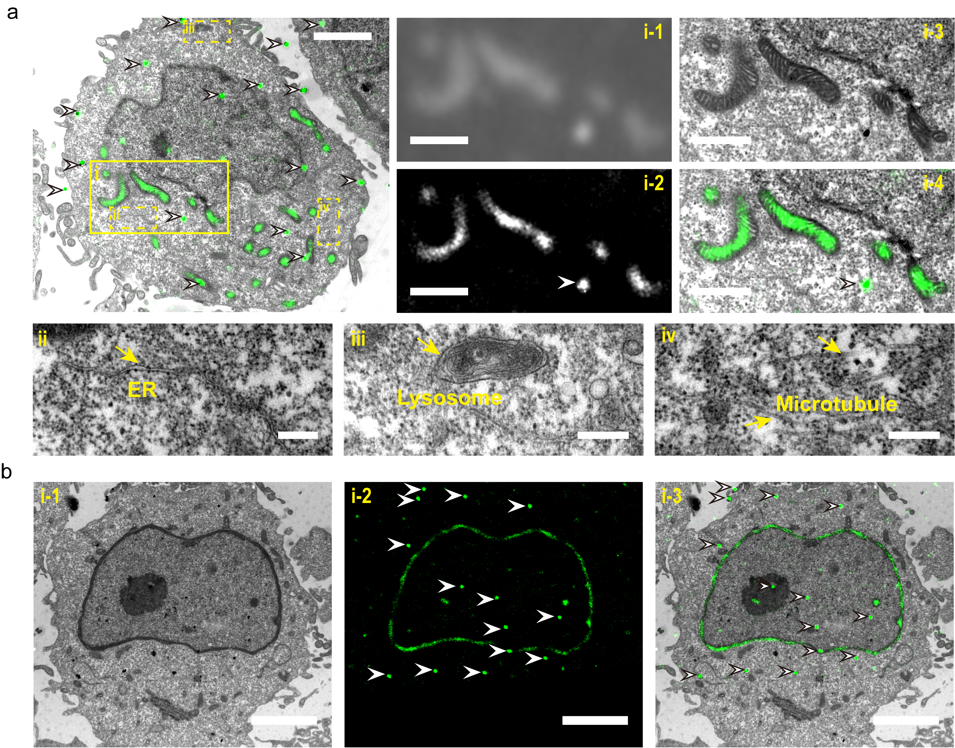
图3:Epon树脂包埋后同层切片高精度光电关联成像。(a) CHO细胞切片的超分辨光电关联成像图,其线粒体由mEosEM标记。(b) CHO细胞切片的超分辨光电关联成像图,其核纤层由mEosEM标记。
代表性科研项目
国家优秀青年科学基金 (主持,在研)
国家自然科学基金面上项目(两项,主持,已结题)
北京市重点研发计划(骨干,在研)
国家重点研发计划 (骨干,已结题)
国家重大科研仪器研制项目(骨干,在研)
10篇代表性论文
Fu Z.#, Peng D.#, Zhang M.#, *, Xue F., Zhang R., He W., Xu T.*, Xu P.* mEosEM withstands osmium staining and Epon embedding for super-resolution CLEM. Nature Methods 2020, 17(1): 55-58.
Zhang M.#, Chang H.#, Zhang Y.#, Yu J., Wu L., Ji W., Chen J., Liu B., Lu J., Liu Y., Zhang J., Xu P.*, Xu T.* Rational design of true monomeric and bright photoconvertible fluorescent proteins. Nature Methods 2012, 9(7): 727-9.
Xu F.#, Zhang M.#, He W., Han R., Xue F., Liu, Z., Zhang F.*, Lippincott-Schwartz J.*, Xu P.* Live cell single molecule-guided Bayesian localization super resolution microscopy. Cell Research 2017, 27(5): 713-716.
Zhang M.#, Fu Z.#, Li C.#, Liu A., Peng D., Xue F., He W., Gao S., Xu F., Xu D., Yuan L., Zhang F., Xu Z., Xu T.*, Xu P.* Fast Super-Resolution Imaging Technique and Immediate Early Nanostructure Capturing by a Photoconvertible Fluorescent Protein. Nano Letters 2020, 20(4): 2197-2208.
Zhang X.#, Zhang M.#, Li D#, He W., Peng J., Betzig E.*, Xu P.* Highly photostable, reversibly photoswitchable fluorescent protein with high contrast ratio for live-cell superresolution microscopy. Proc Natl Acad Sci U S A 2016, 113(37): 10364-10369.
Chang H.#, Zhang M.#, Ji W.#, Chen J., Zhang Y., Liu B., Lu J., Zhang J., Xu P.*, Xu T.* A unique series of reversibly switchable fluorescent proteins with beneficial properties for various applications. Proc Natl Acad Sci U S A 2012, 109(12): 4455-4460.
Xue F.#, He W.#, Peng D., You H., Zhang M.*, Xu P.* SOGO-SOFI, light-modulated super-resolution optical fluctuation imaging using only 20 raw frames for high-fidelity reconstruction. Fundamental Research 2023 online.
Gao S., Xu F., Li H., Xue F., Zhang M.*, Xu P.*, Zhang F.* DETECTOR: structural information guided artifact detection for super-resolution fluorescence microscopy image. Biomedical Optics Express 2021, 12(9): 5751-5769.
Han L., Zhao Y., Zhang X., Peng J., Xu P.*, Huan S.*, Zhang M.* RFP tags for labeling secretory pathway proteins. Biochemical and Biophysical Research Communications 2014, 447(3): 508-512.
Liu L.#, Zhang M.#, Xia Z. Xu P., Chen L., Xu T. Caenorhabditis elegans ciliary protein NPHP-8, the homologue of human RPGRIP1L, is required for ciliogenesis and chemosensation. Biochemical and Biophysical Research Communications 2011, 410 (3): 626-631.
