
跨学部生物医学工程系
赵 扬
电子邮箱:yangzhao@pku.edu.cn
地址:北京市海淀区学院路38号北京大学医学部科技西楼
个人简介:
赵扬,国家优青、万人青拔。中国细胞生物学会标准工作委员会、细胞与基因治疗分会委员。北京大学“拜耳”研究员。
2003年、2009年分获北京大学生命科学学院学士与博士学位。2016年起至今分别于北京大学分子医学研究所(现未来技术学院)和北京大学临床医学高等研究院任研究员、博士生导师。长期研究干细胞和再生医学新技术,在Science、Cell、Circulation、Cell Stem Cell、Hepatology等杂志发表论文30余篇,研究成果获评“中国科学年度十大进展”、“中国高校年度十大科技进展”等。
主要研究方向:
1. 在体重编程和心脏修复再生
围绕心脏疾病中心肌细胞死亡后难以再生的世界级难题,赵扬研究组揭示了一系列在体诱导心肌再生的内、外源调控因子,解决了心梗损伤部位肌成纤维细胞重编程为心肌细胞的低效问题;揭示了其心梗微环境中的负向调控因子——巨噬细胞来源的IFN/Stat1信号通路以及TGF-beta激活的下游Meox1表达;最终利用严格的双重组酶谱系示踪系统验证了“在体重编程”诱导心肌高效再生可行性,为解决心脏再生世界级难题治疗心梗等心脏疾病提供再生医学新途径(图1)。

图1 在体诱导心肌再生的重编程因子基因治疗研究
2.疾病中细胞命运调控网络稳态失衡及重塑
衰老、疾病过程中细胞命运决定的调控网络的崩解或偏移将导致功能细胞乃至组织器官的生理功能或再生潜能受损。本研究组曾报道小分子组合5C诱导小鼠模型损伤肝实质细胞恢复其细胞功能和增殖活力,并逆转小鼠肝病表型;此外,研究组揭示了慢性肝病小鼠模型中OSR1介导的损伤肝星状细胞向间皮细胞转化的倾向,通过干预这一细胞命运调控网络偏移的关键靶点或清除转化中间态细胞均可有效干预肝脏纤维化(图2)。这种“焕新”策略有望广泛应用于纤维化、肿瘤、衰老等相关疾病。
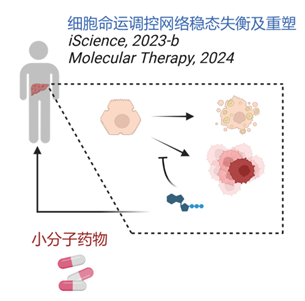
图2 在体诱导细胞命运调控网络重塑的机制及小分子药物研究
3.多能干细胞分化来源复合类器官/器官芯片疾病模型及药筛技术
本研究组和合作者基于活细胞明场图像数据机器学习技术监控干细胞分化,对其进行实时纠错、智能纯化,为体外细胞分化等体系带来高效及稳定性,为未来一体化、智能化细胞分化设备的开发奠定基础。此外,本研究组还开发了DRUG-seq2、PHDs-seq等技术基于转录谱批量、定量评估细胞命运,以开展调控细胞命运的小分子筛选。未来将结合多能干细胞分化来源的复合类器官或器官芯片疾病模型及“数智化”细胞命运药物筛选系统,为在体重编程及细胞命运重塑的靶点发现及新药研发奠定基础。
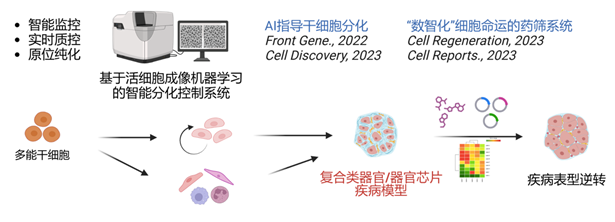
图 3 整合类器官、大数据和人工智能等前沿技术的药筛系统
代表性科研项目:
n 国家自然科学基金优秀青年项目“小分子诱导细胞重编程 (31922020)”,课题负责人,120万,2020.1-2022.12
n “发育编程及其代谢调节”国家重点研发专项“调控哺乳动物心脏和肝脏再生的新策略 (2018YFA0800504)“ 课题负责人,本人负责170万元,2019.9-2024.8
n 国家自然科学基金面上项目“小分子在体原位诱导肝间质细胞转分化为肝实质细胞的研究 (32170743)” 课题负责人,58万,2022.1-2025.12
n 北京市自然科学基金(KY11)“建立稳定、高效、标准化的人源心脏类器官诱导模型及药物评价体系(L232088)”课题负责人,29.3万,2023.11-2026.12
n 国家自然科学基金面上项目“通过调控原位重编程的心梗微环境赋能心脏修复再生的研究(32470882),课题负责人,50万,2025.1-2028.12
10篇代表性论文:
1. Macrophages suppress cardiac reprogramming of fibroblasts in vivo via IFN-mediated intercellular self-stimulating circuit. Hao Wang#, Junbo Yang#, Yihong Cai, Yang Zhao*. Protein & Cell. 2024, 15(12):906-929.
2. Osr1-mediated mesothelial transition of liver mesenchymal cells exacerbates fibrotic liver damage. Xinxin Nian, Pengyan Lin, Yunfei Bai, Donglin Yu, Xinyan Yang, Bin Zhou, Jie Gao, Yang Zhao*. Molecular Therapy. 2024, 32(9):2984-2991.
3. An improved factor combination for in vivo reprogramming of cardiac myofibroblast to cardiomyocyte-like cell with dual recombinase tracing. Jingdong Wu; Hong Zhao; Yanmeng Tao; Chunyan Yang; Yang Yang; Bin Zhou*; Yang Zhao*. Circulation. 2023, 148(21):1728-1731.
4. A live-cell image-based machine learning strategy for reducing variability in PSC differentiation systems. Xiaochun Yang#; Daichao Chen#; Qiushi Sun#; Yao Wang; Yu Xia; Jinyu Yang; Chang Lin; Xin Dang; Zimu Cen; Dongdong Liang; Rong Wei; Ze Xu; Guangyin Xi; Gang Xue; Can Ye; Li-Peng Wang; Peng Zou; Shi-Qiang Wang; Pablo Rivera-Fuentes; Salome Püntener; Zhixing Chen; Yi Liu*; Jue Zhang*; Yang Zhao*. Cell Discovery., 2023, 9(1): 53
5. Transcriptome-based chemical screens identify CDK8 as a common barrier in multiple cell reprogramming systems. Jun Li#; Yunfei Bai#; Yang Liu; Zhongya Song; Yong Yang; Yang Zhao*. Cell Reports., 2023, 42(6): 112566
6. PHDs-seq: a large-scale phenotypic screening method for drug discovery through parallel multi-readout quantification. Jun Li; Jun Chi; Yang Yang; Zhongya Song; Yong Yang; Xin Zhou; Yang Liu*; Yang Zhao*. Cell Regeneration., 2023, 12(1): 22
7. Direct chemical induction of hepatocyte-like cells with capacity for liver repopulation. Yunfei Bai; Zhenghao Yang; Xiaochan Xu; Wanqiu Ding; Juntian Qi; Feng Liu; XiaoXiao Wang; Bin Zhou; Wenpeng Zhang; Xiaomei Zhuang; Guanglu Li; Yang Zhao*. Hepatology, 2023, 77(5):1550-1565.
8. Small-molecule-driven direct reprogramming of mouse fibroblasts into functional neurons. Xiang Li#; Xiaohan Zuo#; Junzhan Jing#; Yantao Ma; Jiaming Wang; Defang Liu; Jialiang Zhu; Xiaomin Du; Liang Xiong; Yuanyuan Du; Jun Xu; Xiong Xiao; Jinlin Wang; Zhen Chai*; Yang Zhao*; Hongkui Deng*. Cell Stem Cell, 2015, 17(2): 195-203.
9. A XEN-like state bridges somatic cells to pluripotency during chemical reprogramming. Yang Zhao*, #; Ting Zhao#; Jingyang Guan#; Xu Zhang#; Yao Fu#; Junqing Ye#; Jialiang Zhu; Gaofan Meng; Jian Ge; Susu Yang; Lin Cheng; Yaqin Du; Chaoran Zhao; Ting Wang; Linlin Su; Weifeng Yang; Hongkui Deng*. Cell, 2015, 163(7): 1678-1691.
10. Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds. Pingping Hou#; Yanqin Li#; Xu Zhang#; Chun Liu#; Jingyang Guan#; Honggang Li#; Ting Zhao; Junqing Ye; Weifeng Yang; Kang Liu; Jian Ge; Jun Xu; Qiang Zhang; Yang Zhao*; Hongkui Deng*. Science, 2013, 341(6146): 651-654.
