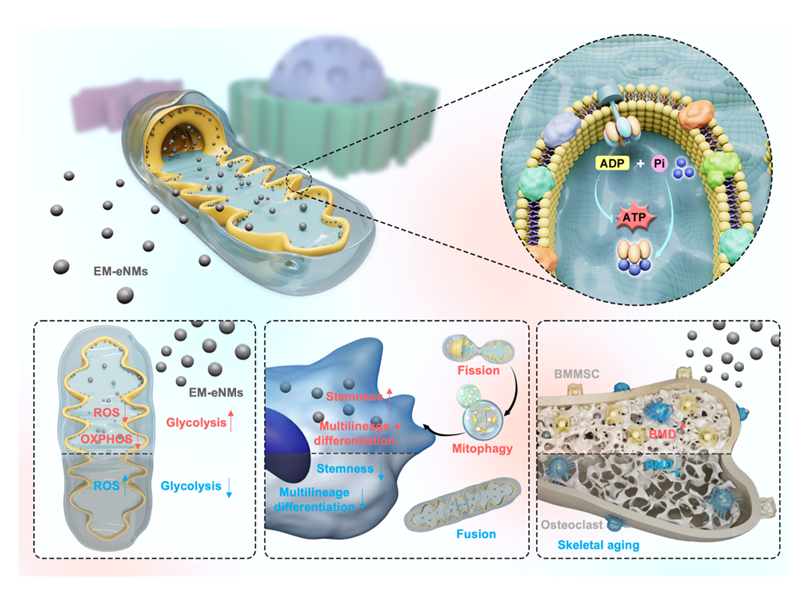
Nat Nanotechnol:高研院王存玉、刘燕团队研发调控能量代谢的纳米药物EM-eNMs,直击线粒体逆转干细胞衰老并改善骨质流失
近日,由北京大学王存玉、刘燕团队、中科院北京纳米能源与系统研究所罗聃研究员团队合作的研究成果发表在《Nature Nanotechnology》杂志上,标题为An energy metabolism-engaged nanomedicine maintains mitochondrial homeostasis to alleviate cellular ageing。该研究基于超小黑磷量子点(BP QDs)开发了能量代谢参与型纳米药物(EM-eNMs),并利用接触电催化选择性地氧化其表面。作为无机多磷酸盐(polyP)的结构类似物,被识别为参与能量代谢的重要物质,在衰老干细胞活力恢复及骨骼老化预防领域展现出突破性潜力,为细胞衰老及年龄相关疾病的干预开辟了全新方向。

研究背景
细胞衰老与年龄相关疾病的防治是全球生命科学领域的核心热点,随着人口老龄化趋势加剧,骨质疏松等因细胞衰老引发的病症发病率持续攀升,严重影响人群健康。其中,能量代谢稳态失衡是驱动细胞衰老的关键诱因,作为能量生成核心的 ATP 合酶,其功能异常会直接导致细胞能量供给紊乱、干细胞功能衰退,因此成为干预细胞衰老的重要潜在靶点。与此同时,纳米药物凭借可调节的生物分布、结构多样性及可定制修饰等优异特性,展现出远超传统药物载体的生物医学潜力,尤其超小纳米材料能够穿透生物屏障、靶向细胞内特定细胞器及生物大分子,为直接调控细胞生理过程提供了新工具。由此,利用仿生纳米药物精准调控细胞能量代谢以干预衰老进程,成为当前极具潜力的研究思考方向。
创新亮点
亮点一:创新制备工艺,赋予纳米药物 “能量代谢模拟” 核心能力
本研究在纳米药物制备技术上实现重要突破。研究者以黑磷量子点(BP QDs)为前驱体,通过 “接触电致催化” 这一创新性技术,成功构建出表面高度暴露磷酸基团的纳米药物(EM-eNMs)。与传统氧化反应直接将 BP QDs 降解为磷酸盐不同,接触电致催化可实现表面氧化结构的可控生成,确保纳米药物结构稳定性的同时,使其能精准模拟能量代谢反应中关键无机化合物多聚磷酸(polyP)的功能,为后续调控细胞能量代谢网络奠定核心基础。这一制备工艺不仅解决了传统纳米材料功能单一、结构可控性差的问题,更让 EM-eNMs 具备了 “参与能量代谢” 的独特优势,成为干预细胞衰老的 “精准武器”。
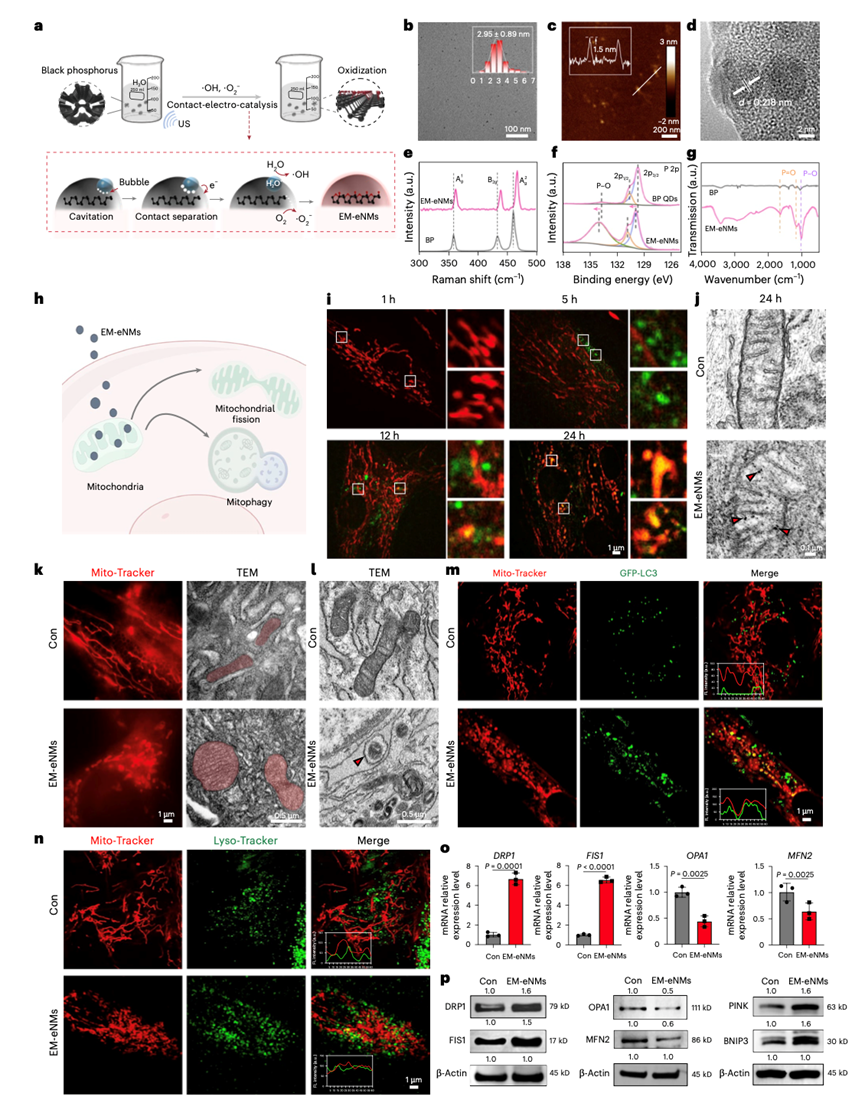
亮点二:精准靶向线粒体,解锁干细胞衰老逆转新机制
在作用机制层面,EM-eNMs 展现出卓越的靶向性与调控能力。研究证实,该纳米药物能精准定位衰老骨髓间充质干细胞(BMMSCs)的线粒体 —— 这一调控细胞衰老的核心细胞器。EM-eNMs 可驱动线粒体分裂、激活线粒体自噬,并增强糖酵解过程,维持 BMMSC 的干性特征与成骨分化潜能。进一步的机制解析揭示,EM-eNMs 可直接与线粒体中的 ATP 合成酶结合,通过特异性调控 DRP1 基因表达,激活线粒体自噬通路,高效清除受损线粒体,恢复线粒体正常结构与能量供给功能,从细胞器层面阻断干细胞衰老进程。这一发现突破了传统研究仅聚焦细胞表面标志物或宏观表型的局限,为从线粒体稳态调控视角逆转细胞衰老提供了全新理论依据。
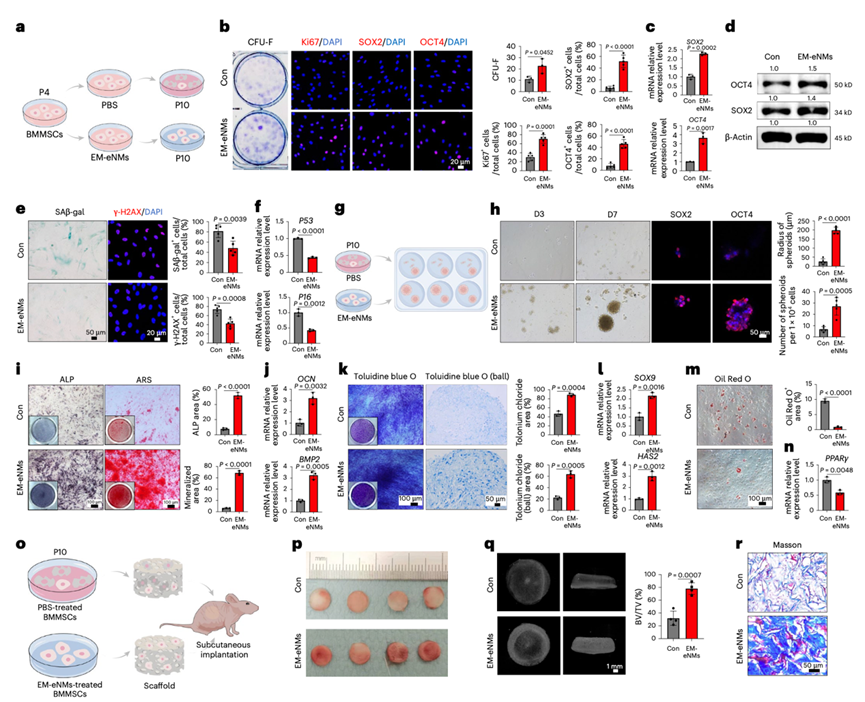
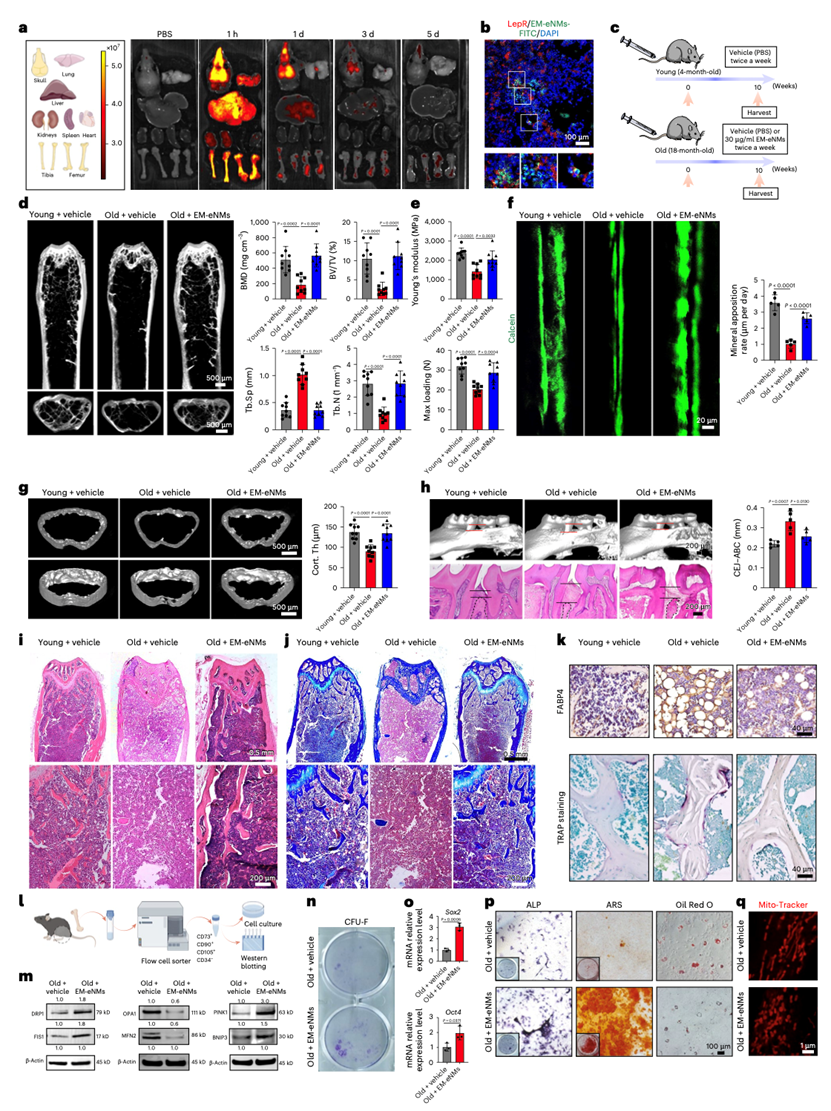
亮点三:骨组织靶向递送,实现年龄相关疾病 “精准治疗”
在临床转化潜力方面, EM-eNMs 在全身递送过程中能选择性富集于骨组织,有效规避对其他器官的非特异性作用,大幅降低潜在副作用。在老年小鼠骨质疏松模型中,EM-eNMs 通过增强线粒体分裂与自噬活性,不仅显著增加骨密度、改善骨微结构,逆转骨质疏松性骨丢失,更能在原位激活老化 BMMSCs 的干性,恢复其成骨分化潜能,实现 “修复组织损伤 + 逆转细胞衰老” 的双重效果。这种 “精准靶向 + 功能修复” 的特性,让 EM-eNMs 有望成为治疗骨质疏松等年龄相关骨病的理想候选药物,也为其他组织器官衰老相关疾病的靶向治疗提供了可借鉴的技术框架。
北京大学刘燕教授、北京大学王存玉院士、中科院北京纳米能源与系统研究所罗聃研究员为该论文共同通讯作者,北京大学博士后陈丽媛为该论文第一作者。此外,该工作也得到了北京大学蒋楠研究员、北京大学黄小帅研究员、北京大学徐正仁研究员课题组的重要支持和帮助。该研究得到国家重点研发计划、国家自然科学基金等基金的经费支持。