
Biomaterials:刘燕/王存玉团队发表纳米材料在口腔颌面组织抗衰老与再生中的策略、机制及应用
近日,北京大学口腔医院、临床医学高等研究院、细胞稳态与衰老性重大疾病北京研究中心刘燕教授、王存玉院士团队撰写的研究综述发表于《Biomaterials》杂志,标题为Nanomaterial-Based Strategies for Anti-Aging and Regeneration in Oral and Maxillofacial Tissues。本文系统阐述衰老微环境对口腔颌面组织再生的多维抑制机制,深入解析细胞功能退化、基质重塑失衡、免疫微环境紊乱及代谢稳态破坏等关键病理过程的协同作用。基于前沿研究进展,重点强调功能化纳米材料在精准调控衰老微环境中的创新优势,包括时空选择性清除衰老细胞、智能调节基质重建、恢复免疫稳态与靶向干预代谢网络,为构建新一代重塑衰老状态的口腔再生策略提供理论基础。

随着全球人口老龄化的加剧,深入揭示衰老介导的组织退变与修复受损机制已成为亟待解决的科学难题。尤其在口腔颌面部组织中,再生能力的下降不仅影响局部功能,更显著削弱了患者的生活质量。
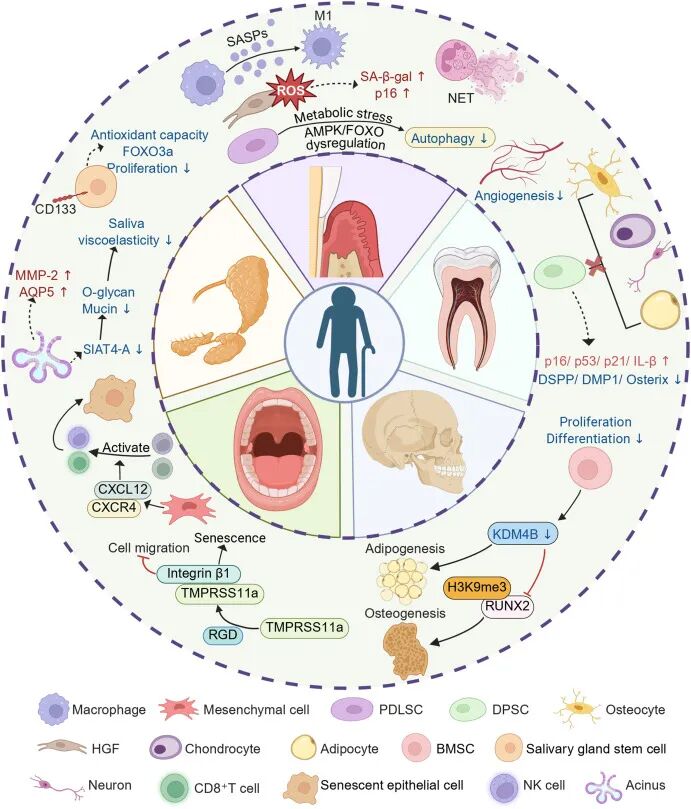
本研究系统阐述了衰老微环境对口腔颌面部多组织再生的负面影响,涵盖牙周、牙髓、颅颌面骨、口腔黏膜及唾液腺等关键结构。衰老过程中伴随巨噬细胞M1极化、中性粒细胞胞外诱捕网形成、自噬功能障碍、干细胞功能衰退、血管生成减弱、成骨-成脂平衡失调、上皮细胞衰老及腺体分泌功能下降等一系列病理变化。具体而言,牙周组织在氧化应激作用下出现成纤维细胞DNA与线粒体损伤,伴随SA-β-gal活性上升与p16表达增加,并通过衰老相关分泌表型进一步加剧炎症反应;牙髓干细胞则表现为增殖能力减弱、成牙本质向分化标志物表达降低及相关衰老基因上调;在颅颌骨中,组蛋白去甲基化酶KDM4B缺失导致H3K9me3-RUNX2调控紊乱,促使间充质干细胞向脂肪分化倾斜,加速骨组织衰老;口腔黏膜中TMPRSS11a与CXCL12-CXCR4信号通路上调诱导上皮细胞衰老并阻碍损伤修复;唾液腺则呈现腺泡萎缩、组织纤维化、抗氧化能力下降以及CD133+干细胞群耗竭,最终导致分泌功能严重受损。
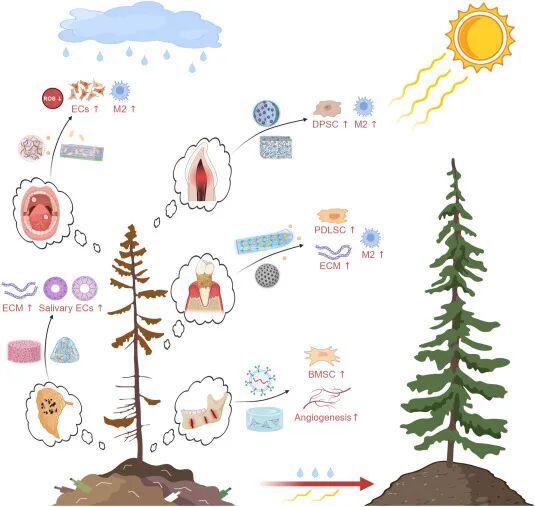
近年来,功能化纳米材料的快速发展为精准调控衰老微环境带来了革命性契机。这些工程化材料具备多维治疗潜能:可通过靶向生物标志物实现时空特异性的衰老细胞清除,借助仿生纳米结构促进智能化基质重建,并通过调节免疫稳态和代谢通路实现多层次的组织再生调控。针对衰老牙周组织,纳米递送系统可有效促进细胞外基质沉积、增强牙周膜干细胞增殖,并通过抑制M1型巨噬细胞极化、诱导M2型修复表型实现免疫微环境重塑。在牙髓修复中,纳米支架与生物活性微球通过调控巨噬细胞向M2型极化并提升牙髓干细胞增殖与分化潜能,显著增强组织再生能力。对于衰老口腔黏膜,组织黏附性纳米材料、静电纺丝纳米纤维与Janus水凝胶能够促进内皮细胞增殖、减轻氧化应激损伤,并推动M2型免疫微环境形成以加速黏膜修复。在唾液腺再生方面,核壳结构纳米纤维与功能化水凝胶通过促进细胞外基质重建和腺泡细胞增殖,有效恢复分泌功能。在颅颌面骨缺损修复中,3D打印纳米支架、纳米囊泡及DNA四面体纳米复合体系可显著增强骨髓间充质干细胞的成骨分化与血管生成能力,从而促进骨组织再生。
北京大学口腔医院、临床医学高等研究院、细胞稳态与衰老性重大疾病北京研究中心刘燕教授、王存玉院士为该论文共同通讯作者,北京大学口腔医院博士后蔡鑫嘉、北京大学口腔医院硕士崔莹莹为该论文共同第一作者。该研究得到国家重点研发计划、国家自然科学基金重点项目、细胞稳态与衰老性重大疾病北京研究中心、国家资助博士后研究人员计划等项目的支持。
