
细胞稳态与衰老性重大疾病北京研究中心
刘 燕
邮箱:orthoyan@bjmu.edu.cn
地址:北京市海淀区学院路38号
个人简介:
刘燕,北京大学博雅特聘教授、北京大学口腔医院教授/博士生导师,任北京大学医学部人事处副处长(挂职)、北京大学口腔颅颌面干细胞与全身健康转化研究中心主任、北京大学口腔医院中心实验室副主任、北京大学天然药物及仿生药物国重点PI、细胞稳态与衰老性重大疾病北京中心PI、北京慢性病防治与健康教育研究会青年专家委员会主任委员及评审专委会副主任委员、中华口腔医学会口腔生物医学专委会常委,International Journal of Oral Science、Exploration等杂志编委。
主要研究方向:
1.基于纳米材料的组织衰老调控研究
本研究基于ATP合酶的结构与功能,开发了能量代谢介导的纳米材料(EM-eNMs),用于重塑衰老骨髓间充质干细胞(BMMSCs)功能,延缓骨骼衰老。EM-eNMs 可靶向进入BMMSCs线粒体,促进线粒体分裂、线粒体自噬与糖酵解,维持干性与多功能性。其通过结合ATP合酶并诱导DRP1表达增强线粒体自噬。在系统给药下,EM-eNMs可精准靶向骨组织,逆转衰老小鼠骨质疏松性骨丢失,并原位恢复干细胞的成骨能力。研究表明,EM-eNMs有望作为抗衰老与骨相关疾病的靶向治疗新策略。
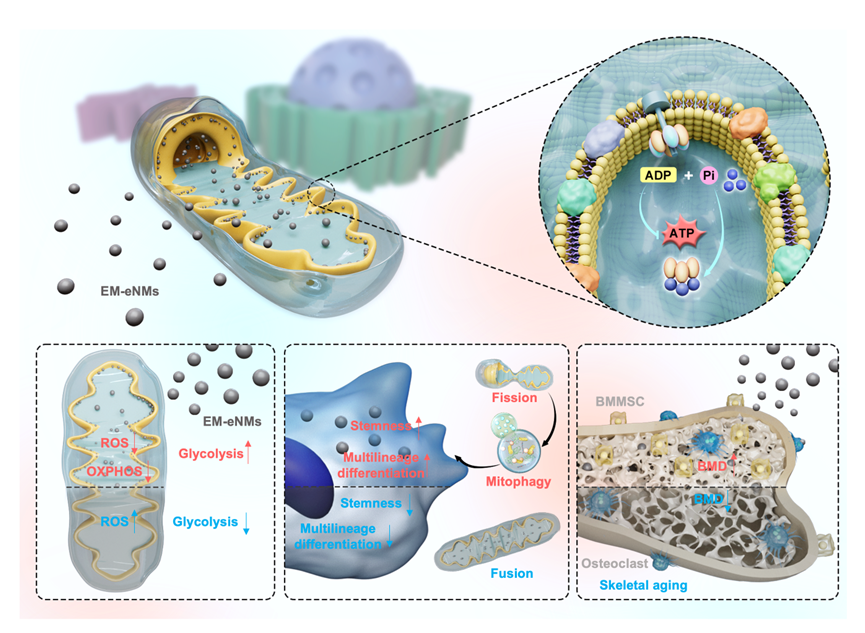
图1. EM-eNMs精准调控线粒体稳态抑制骨衰老
2. 组织发育与衰老逆转
本研究通过肌腱发育过程的转录组分析发现,胞外基质蛋白Postn可维持肌腱干/祖细胞(TSPCs)功能,并促进肌腱再生。重组蛋白 rPOSTN 可增强 TSPCs 的增殖能力、干性维持及成肌腱分化潜能,并延缓其衰老过程。大鼠跟腱离断实验表明,加载 rPOSTN的仿生胶原支架可促进内源性 TSPCs 的募集及有序胶原重建,有效恢复肌腱结构与功能,显著提升大鼠力学性能与运动能力。研究表明,Postn是调控肌腱发育与再生的关键因子,具有良好的转化应用前景。
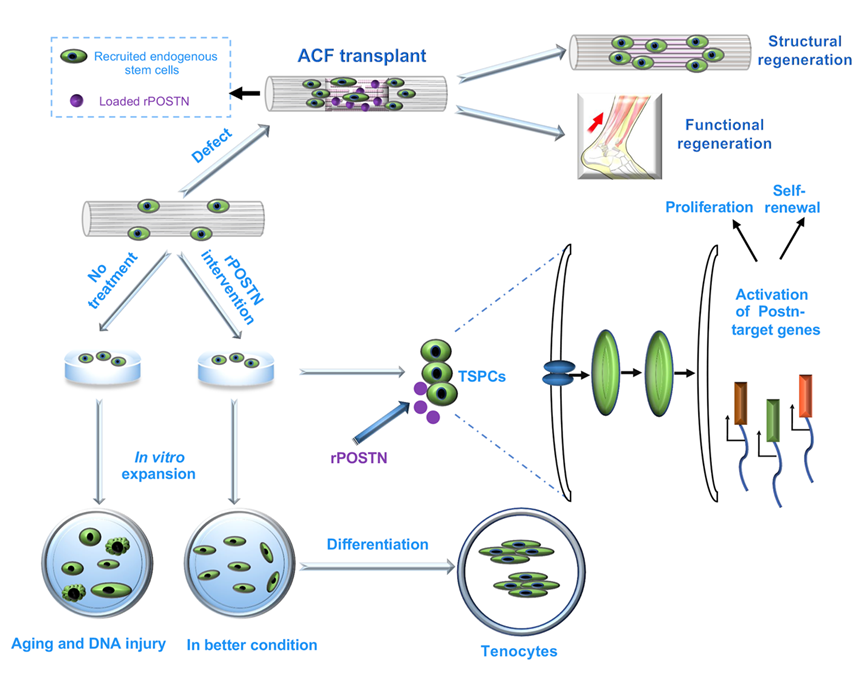
图2. Postn调控肌腱发育与再生
3. 基于胶原有序结构的仿生多功能材料的研发
本研究通过胶原与超细无机纳米线共组装并矿化,构建了一种具自产电活性的仿生矿化支架(sp-EMS)。sp-EMS通过自发电化学反应产生微弱电流,激活电压门控钙通道,增强ATP介导的细胞骨架重塑,促进干细胞成骨分化;同时,sp-EMS可产生活性氧抑制细菌黏附与活性,该生物学效应高度依赖sp-EMS自身电流。动物实验显示,sp-EMS在大鼠颅骨缺损、兔下颌开放性缺损及比格犬垂直骨缺损等多种感染模型中均实现了显著的骨再生修复,展现出良好的抗菌与成骨双重功能。
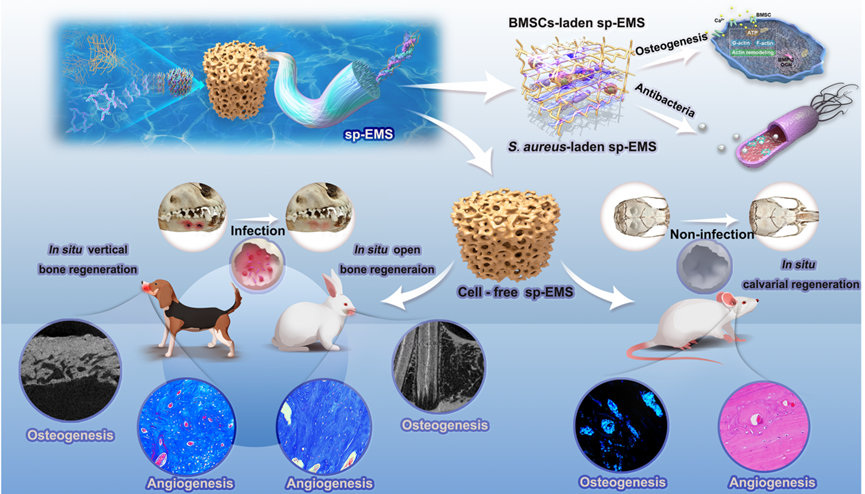
图3. 研发自产电仿生矿化胶原,实现感染性骨缺损原位再生
代表性科研项目:
1. 项目负责人:无机抗菌纳米线-胶原多级组装仿生支架材料调控免疫炎症微环境并修复感染性骨缺损的研究,国家自然科学基金重点项目(2023.1-2027.12,82230030,261万)
2. 课题负责人:高效体热自供能发电器件研发及其在难愈创面再生中的应用,国家重点研发计划,(2024.12-2029.12,2024YFA1210403, 374.96万元)
3. 项目负责人:仿生纳米材料研发与口腔硬组织再生, 国家“万人计划”青年拔尖人才(2019.09-2022.09, 180 万)
4. 项目负责人:外场响应双功能仿生植骨支架的构建及其精准治疗感染性骨缺损的研究,国际(港澳台)科技合作项目(2022.09-2024.09,Z221100002722003,150万)
5. 项目负责人:基于胶原有序结构的仿生多功能支架的构建及其修复感染性颅颌面复合组织缺损的研究,北京市自然重点研究专题(2023.11-2026.12,L234017,100万)
10篇代表性论文:
1. Chen LY, Fan Y, Jiang N, Huang XS, Yu M, Zhang H, Xu Z, He D, Wang Y, Ding C, Wu X, Li C, Zhang S, Liu H, Shi X, Zhang F, Zhang T, Luo D*, Wang CY*, Liu Y* An energy metabolism-engaged nanoparticle rejuvenates mesenchymal stem cells and prevents skeletal aging by maintaining mitochondrial homeostasis. Nature Nanotechnology 2025 (In press)
2. Li ZX, He DQ, Wang Y, Jin SS, Shi CY, Zhu LS, Guan B, Li ZX, Zhang T, Zhou YH, Luo D*, Liu Y*. Self-promoted electroactive mineralized scaffolds for infected bone regeneration. Nature Commun. 2023, 14: 6963.
3. Wang Y, Jin SS, Luo D, He DQ, Shi CY, Zhu LS, Guan B, Li ZX, Zhang T, Zhou YH, Wang CY, Liu Y*. Functional regeneration and repair of tendons using biomimetic scaffolds loaded with recombinant periostin. Nature Commun 2021, 12:1293.
4. Jin SS,Wang Y,Wu XL, Zhu LS, Niu YT, Zhou YS*, Liu Y*. Young Exosome Bio-nanoparticles Rescue Aging-impaired Tendon Stem/Progenitor Cell Function and Reparative Capacity. Adv Mater. 2023; 35(18):e2211602.
5. Wang QB, Li ZX, Zhang YF, Gui HZ, Chen LY, Zhang H, Liu HB, Li C, Zhang SY, Shi XM, Feng LF, Qi MC, Luo D, Di P, Liu Y*. Multiphase Mineralized Collagen Scaffold for Infected Bone Regeneration through Oxidative Metabolism Modulation. Adv Funct Mater. 2025,2500593.
6. Ling SY, Chen LY, Liu C, Guo BW, Fan YJ, Li Z, Liu Y*, Luo D*. Ultrathin ZIF-8 Coating-Reinforced Enzyme Nanoformulation Avoids Lysosomal Degradation for Senile Osteoporosis Therapy. Adv Funct Mater. 2024, 2410931.
7. Zhang Y, Li Z, Guo B, Wang Q, Chen L, Zhu L, Zhang T, Wang R, Li W, Luo D, Liu Y*. A Zinc Oxide Nanowire-Modified Mineralized Collagen Scaffold Promotes Infectious Bone Regeneration. Small. 2024;20(19):e2309230
8. Zhang Y, Li Z, Guo H, Wang Q, Guo B, Jiang X, Liu Y, Cui S, Wu Z, Yu M, Zhu L, Chen L, Du N, Luo D, Lin Y, Di P, Liu Y*. A Biomimetic Multifunctional Scaffold for Infectious Vertical Bone Augmentation. Adv Sci (Weinh). 2024:e2310292
9. Wang RX, Wang Y, Niu YT, He DQ, Jin SS, Li ZX, Zhu LS, Chen LY, Wu XL, Ding CY, Wu TH, Shi XM, Zhang H, Li C, Wang X, Xie ZW, Li WR, Liu Y*. Deep Learning-Predicted Dihydroartemisinin Rescues Osteoporosis by Maintaining Mesenchymal Stem Cell Stemness through Activating Histone 3 Lys 9 Acetylation. ACS Central Science. 2023, 9(10): 1927–1943.
10. Yu M, Luo D, Qiao J, Guo JS, He DQ, Jin SS, Tang L, Wang Y, Shi X, Mao J, Cui SJ, Fu Y, Li ZX, Liu DW, Zhang T, Zhang C, Li Z*, Zhou YS*, Liu Y*. A hierarchical bilayer architecture for complex tissue regeneration. Bioact Mater 2022,10:93-106.
