
王嘉东
邮箱:wangjd@bjmu.edu.cn
地址:北京市海淀区学院路38号
个人简介:
王嘉东,北京大学博雅特聘教授,北京大学医学部副主任,北京大学基础医学院放射医学系主任,国家杰出青年基金获得者。王嘉东教授长期致力于放射医学与肿瘤治疗研究,重点研究DNA损伤修复与肿瘤发生和治疗抗性的关系。近五年以通讯作者在Molecular Cell,EMBO J,Journal of Clinical Investigation,Nucleic Acids Research,PNAS,Cell Reports,Oncogene等杂志上发表研究论文,系统性揭示了DNA损伤修复的精准调控网络及其生物学效应。王嘉东教授主持国家自然科学基金重点项目、科技部重点研发计划、国家自然科学基金面上项目和北京市自然科学基金面上项目等多个项目。荣获中国毒理学会优秀青年学者奖、拜耳学者奖等荣誉。
主要研究方向:
1、 DNA损伤修复关键途径的快速触发及通路选择机制
DNA双链断裂主要由同源重组HR和非同源末端连接NHEJ两条修复途径完成。若修复途径选择出现错误,则会导致基因组与染色体不稳定、免疫缺陷、癌症等疾病发生的严重后果,但目前对两条损伤修复途径HR和NHEJ的选择和平衡机制并不明确。此外,在正常的生命过程中,DNA双链断裂损伤修复机制被限制,避免对DNA复制等过程进行不必要的干扰;而在DNA损伤发生时,修复机器快速识别损伤信号并选择不同的损伤修复途径启动损伤应答过程。因此, DNA双链断裂修复的快速触发及修复通路选择机制一直是领域内的研究热点和难点。针对这一科学问题,我们开展了系统性研究,先后揭示了DNA损伤修复同源重组修复的触发机制,以及同源重组修复HR和非同源末端连接修复NHEJ通路的选择机制。
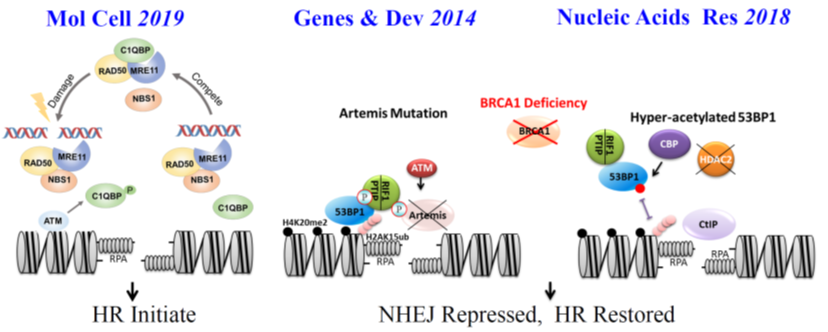
图1 揭示放射损伤修复关键途径同源重组修复的触发及选择机制
2、 揭示基因组稳定性维持与肿瘤放化疗敏感性的关系
在肿瘤细胞中,许多基因处于高度转录活跃状态,这种高水平的转录活动为肿瘤的快速增殖提供了动力,但也给DNA复制带来了严峻挑战。为了在这种高转录压力下维持基因组稳定,肿瘤细胞发展出一系列复杂的机制来协调转录和复制的相互作用,避免复制叉的过度停滞与损伤。因此,破解肿瘤细胞如何在维持高转录活性的同时保持基因组稳定,已成为癌症治疗中的关键挑战。首次鉴定出RNA-DNA杂合体(Replication Fork-associated RNA-DNAs, RF-RDs)作为转录活跃区停滞复制叉的重要保护因子,并阐明了RNA解旋酶DDX39A在调控RF-RDs中的核心功能。这项发现不仅为保持转录活跃区DNA复制叉的稳定性提供了新见解,提出RF-RDs为转录活跃区停滞复制叉独立于RAD51的重要保护因子,还为提高铂类药物耐药肿瘤的化疗效果提供了有力的科学依据和干预策略。
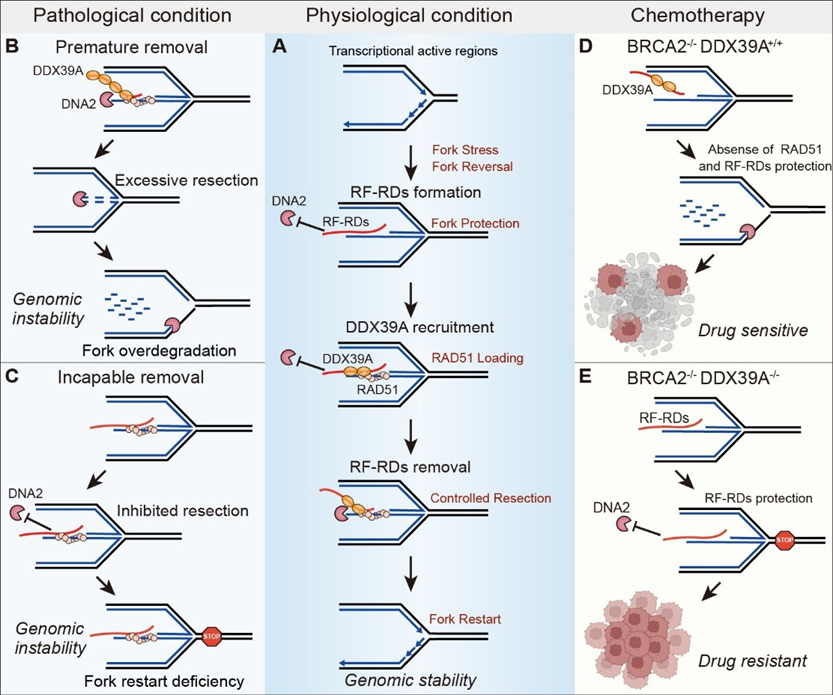
图2 揭示清除复制叉特异性RNA克服肿瘤化疗耐药的新策略
3、 多维度肿瘤合成致死新靶点的发现
BRCA2缺陷会阻碍正常细胞的增殖和胚胎的发育,然而BRCA2缺陷在个体中却显著驱动肿瘤的发生,这一现象被称为“BRCA2悖论”。通过研究揭示这一悖论的内在机制,可以解答BRCA2缺陷导致肿瘤发生的原因,并有助于找到治疗BRCA2缺陷相关肿瘤的治疗靶点和潜在药物。课题组充分发挥秀丽隐杆线虫遗传筛选的独特优势,成功在生物体水平上挽救了BRCA2缺陷导致的胚胎死亡,同时揭示了纺锤体组装检查点关闭是导致BRCA2缺陷肿瘤细胞存活的关键原因,从而为治疗携带BRCA2突变的癌症患者提供了潜在的治疗策略。
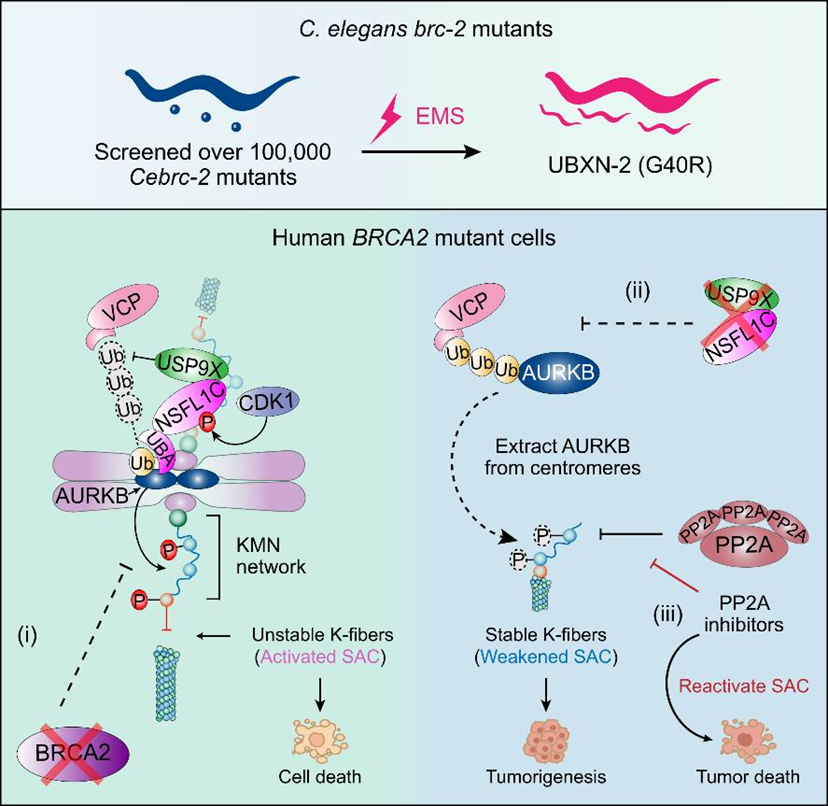
图3 揭示BRCA2缺陷肿瘤细胞的演化适应性机制,并提出潜在的肿瘤治疗合成致死策略
代表性科研项目:
国家自然科学基金杰出青年科学基金项目(项目负责人) 2022-2025 400万
国家自然科学基金重点项目(项目负责人) 2023-2027 291万
国家自然科学基金国际合作项目 2017-2020 280万
重点研发计划“重大慢病发生机制”(课题组长) 2016-2021 220万
重点研发计划“蛋白质机器与生命”(课题骨干) 2017-2022 200万
10篇代表性论文:
1. Xu, Z., Nie, C., Liao, J., Ma, Y., Zhou, X. A., Li, X., Li, S., Lin, H., Luo, Y., Cheng, K., Mao, Z., Zhang, L., Pan, Y., Chen, Y., Wang, W., & Wang, J*. DDX39A resolves replication fork-associated RNA-DNA hybrids to balance fork protection and cleavage for genomic stability maintenance. Mol Cell. 2025;85 (3) (Cover Story)
2. Bai Y, Wang W, Li S, Zhan J, Li H, Zhao M, Zhou X, Li S, Li S, Huo Y, Shen Q, Zhou M, Zhang H, Luo J, Sung P, Zhu W, Xu Z, Wang J*. C1QBP Promotes Homologous Recombination by Stabilizing MRE11 and Controlling the Assembly and Activation of MRE11/RAD50/NBS1 Complex. Mol Cell. 2019;75 (6) (Cover Story).
3. Luo, Y, Li, J, Li, X, Lin, H, Mao, Z, Xu, Z, Li, S, Nie, C, Zhou, XA, Liao, J, Xiong, Y, Xu, X, Wang, J*. The ARK2N–CK2 complex initiates transcription-coupled repair through enhancing the interaction of CSB with lesion-stalled RNAPII (2024). Proc Natl Acad Sci U S A, 121(24), e2404383121.
4. Wang J, Chen Y, Li S, Liu W, Zhou X A, Luo Y, Xu Z, Xiong Y, Cheng K, Ruan M, Yu W, Li X, Wang W, Wang, J*. (2024). PP2A inhibition causes synthetic lethality in BRCA2-mutated prostate cancer models via spindle assembly checkpoint reactivation. J. Clin. Investig, 134(1), e172137.
5. Nie C, Zhou X A, Zhou J, Liu Z, Gu Y, Liu W, Zhan J, Li S, Xiong Y, Zhou M, Shen Q, Wang W, Yang E, Wang, J*. (2023). A transcription-independent mechanism determines rapid periodic fluctuations of BRCA1 expression. EMBO J, 42(15), e111951.
6. Zhou XA, Zhou J, Zhao L, Yu G, Zhan J, Shi C, Yuan R, Wang Y, Chen C, Zhang W, Xu D, Ye Y, Wang W, Shen Z*, Wang W*, Wang J*. KLHL22 maintains PD-1 homeostasis and prevents excessive T cell suppression. Proc Natl Acad Sci U S A. 2020;117(45):28239-28250.
