
导师队伍
王 茜
邮箱:xi_wang@bjmu.edu.cn
地址:北京市海淀区学院路38号
个人简介:
王茜博士毕业于美国康奈尔大学,在哈佛大学干细胞与再生生物系、哈佛大学干细胞研究中心进行博士后训练,师从Douglas Melton院士,从事干细胞来源类器官的构建、递送与应用。主持了国家自然科学基金项目(优青、面上、青年)、北京市自然科学基金等,担任国家重点研发计划课题负责人。获得北京大学第三医院优秀人才奖、美国ALPCO青年研究员奖和CAB青年学者奖。任中国医药生物技术协会生物医学成像技术分会委员、中国医学装备协会组织再生分会委员。
主要研究方向:
随着我国人口老龄化趋势的不断加剧,细胞再生治疗在临床医学上的需求日益凸显。虽然已有细胞疗法应用于临床,仍存在供体短缺、免疫排斥、缺血缺氧等问题。基于此,课题组1)构建了干细胞来源胰岛类器官和血管类器官用于疾病模拟、药物筛选和细胞递送;2)研发低免疫原性、耐缺氧的增强型干细胞及其衍生物,提高细胞存活率;3)开发具有生物相容性和安全性的细胞封装装置、支架材料、水凝胶等,用于细胞递送(图1)。
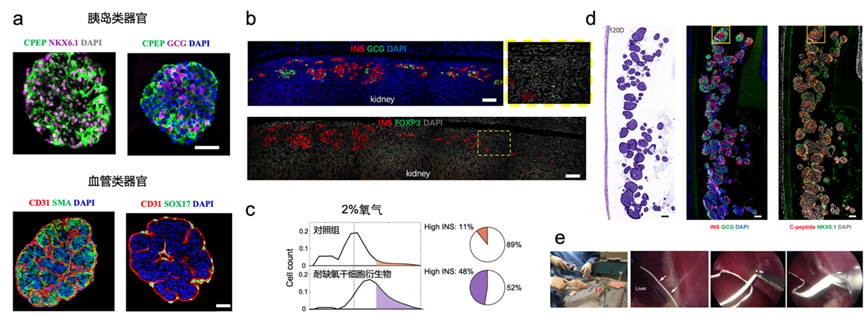
图1. (a)干细胞来源胰岛类器官与血管类器官的构建;(b) 免疫调节的增强型干细胞局部诱导形成免疫豁免微环境延缓免疫排斥;(c) 耐缺氧的干细胞来源胰岛类器官在缺氧条件下维持细胞特性;(d) 具有生物相容性和安全性的细胞封装装置递送干细胞来源胰岛类器官;(e) 载有干细胞来源胰岛类器官的细胞封装装置在大动物中的植入与取回。
研究方向一:基于干细胞来源胰岛类器官的免疫保护策略研究
为了开发无需长期使用免疫抑制剂的异体细胞疗法,实现干细胞来源胰岛类器官的免疫保护。课题组前期构建了具有特殊微纳拓扑结构的新型细胞封装装置,具备优异的生物相容性、安全性与可大规模生产特性。该装置成功在小鼠体内实现了对异体鼠源胰岛细胞和人源干细胞分化胰岛类器官的免疫保护,并进一步在大动物体内验证了对人干细胞来源胰岛类器官的保护效果(Science Translational Medicine, 2021;美国发明专利US20220118025A1)。为提升生物相容性、减少异物反应,进而采用双性离子基团修饰聚氨酯材料,开发了新一代抗异物反应封装装置。该装置已在大动物模型中成功实现微创植入与取回。(Advanced Materials, 2021;国际发明专利WO2020223525A1)。在物理屏障基础上,开发了功能增强型间充质基质细胞(eMSCs),用于局部微环境的主动免疫调控。该策略在小鼠模型中有效延长了异体胰岛细胞的存活时间,并成功在移植局部诱导形成了具有免疫调节功能的调节性T细胞。(Science Advances, 2022;Advanced Science, 2021;国际发明专利WO2023168430A1)。
研究方向二:增强干细胞来源胰岛类器官移植后存活与功能维持
为了解决胰岛类器官移植后缺血缺氧的问题,提高细胞移植后存活率,并减少因缺氧导致的细胞凋亡。课题组前期揭示了干细胞来源胰岛类器官在缺氧条件下功能衰退的分子机制,并发现上调内皮素3(EDN3)表达可显著改善β细胞在低氧环境中的功能与特征性标记物,提供了新的干预靶点(Nature Communications, 2025)。构建干细胞来源血管类器官,拟用于促进胰岛类器官的重新血管化(Cell Stem Cell, 2025; Angiogenesis, 2025)。同时,还构建了双层复合脱细胞基质支架,能减少胰岛细胞聚团导致的缺氧坏死,提高胰岛细胞在体内移植后的存活率(Biomaterials, 2017)。
代表性科研项目:
1. 国家自然科学基金优秀青年科学基金项目(海外),辅助细胞治疗的生物材料,2024-01-01至2027-12-31,300万
2. 国家自然科学基金面上项目,新型细胞封装装置在胰岛类器官递送中的应用研究,2025-01-01至2028-12-31,50万
3. 国家自然科学基金青年科学基金项目,干细胞衍生的功能增强型间充质细胞在糖尿病足溃疡治疗中的应用研究,2025-01-01至2027-12-31,30万
4. 国家重点研发计划“前沿生物技术”专项,项目“模拟代谢综合征的多器官疾病模型构建与应用研究”中子课题“基于多器官模型的代谢综合征病理机制与组织再生研究”, 2025-06至2028-05,290万
5. 北京市自然科学基金,仿生木质多层级结构的再生氧化纤维素基多功能伤口敷料,2024-10-01至2027-09-30,30万
10篇代表性论文:
1. Wang X#, Brielle S#, *, Kenty-Ryu J, Korover N, Bavli D, Pop R, Melton A. D*. Improving cellular fitness of human stem cell-derived islets under hypoxia. Nature Communications, 2025, 16: 4787. (#first author)
2. Pan ZH#, Yao QY#, Kong WJ, Ma XJ, Tian LL, Zhao Y, Zhu ST, Chen S, Sun MZ, Liu J, Jiang SM, Ma JX, Liu QJ, Peng XH, Li XX, Hong ZX, Hong Y, Wang X, Liu JR, Zhang JJ, Zhang W, Sun BB, Pahlavan S, Xia YC, Shen WM, Liu YY, Jiang WJ, Xie ZW, Kong W*, Wang X*, Wang K*. iPSC-derived venous endothelial cells for modeling vascular malformation and drug discovery. Cell Stem Cell, 2025, 32, 1-19. (*corresponding)
3. Wang X, Zeng ZY, Li DY, Wang K, Zhang W*, Yu Y*, Wang X*. Advancements and challenges in immune protection strategies for islet transplantation. Journal of Diabetes, 2025, 17: e70048. (*corresponding)
4. Zhao Y, Sun MZ, Pan ZH, Kong WJ, Hong ZX, Zhang W, Sun BB, Zhang JJ*, Wang X*, Wang K*. A novel quantitative angiogenesis assay based on visualized vascular organoid. Angiogenesis, 2025, 28: 10. (*corresponding)
5. Zhao Y#, Wang X#, Wang K*. Transcription factor-mediated programming of stem cell fate. Trends in Cell Biology, 2023, 33 (8). (#first author)
6. Wang X, Wang K, Yu M, Velluto D, Hong XC, Wang B, Chiu A, Melero-Martin JM, Tomei AA, Ma ML*. Engineered immunomodulatory accessory cells improve experimental allogeneic islet transplantation without immunosuppression. Science Advances, 2022, 8, eabn0071.
7. Wang X, Maxwell KG, Wang K, Bowers DT, Flanders JA, Liu WJ, Wang LH, Liu QS, Liu QY, Naji A, Wang Y, Wang B, Chen J, Ernst AU, Melero-Martin JM, Millman JR*, Ma ML*. A nanofibrous encapsulation device for safe delivery of insulin-producing cells to treat type 1 diabetes. Science Translational Medicine, 2021, 13, 596, eabb4601.
8. Liu QS#, Wang X#, Chiu A, Liu WJ, Fuchs S, Wang B, Wang LH, Flanders JA, Zhang YD, Wang K, Melero-Martin JM, Ma ML*. A zwitterionic polyurethane nanoporous device with low foreign body response for islet encapsulation. Advanced Materials, 2021, 2102852. (#first author)
9. Ni Su#, Jiang LY#, Wang X#, Gao PL, Wang CY, Luo Y* Membrane-binding adhesive particulates enhance the viability and paracrine function of mesenchymal cells for cell-based therapy. Biomacromolecules, 2019, 20, 1007-1017. (#first author)
10. Wang X#, Wang K#, Zhang W#, Qiang M, Luo Y*. A bilaminated decellularized scaffold for islet transplantation: structure, properties and functions in diabetic mice. Biomaterials, 2017, 138: 80-90. (#first author)
