
研究员队伍
胡国立
邮箱:guoli_hu@bjmu.edu.cn
地址:北京市海淀区学院路38号
个人简介:
2018年毕业于上海交通大学获理学博士学位。2018-2023年先后在美国杜克大学、德克萨斯大学西南医学中心进行博士后研究。2023-2025年于美国德克萨斯大学西南医学中心内科学系任讲师。致力于研究人类骨相关疾病的分子基础和细胞信号,迄今共发表论文20余篇,其中以第一作者(含共同)在JCI Insight、EMBO Reports、Cell Death & Disease等杂志发表研究论文8篇。国际会议特邀报告10余次,曾获John Haddad青年学者奖、Harold Frost青年学者奖、及美国骨矿研究学会青年学者奖等学术荣誉。担任Stem Cells、The FASEB J等杂志审稿人。
主要研究方向:
1. 氨基酸代谢调控骨骼干细胞分化:利用代谢组学分析结合基因敲除小鼠模型系统性地研究谷氨酰胺代谢途径对骨骼干细胞分化命运的调控作用。相关研究结果发表在Cell Metabolism、JCI Insight、EMBO Reports等杂志。
代表性成果:谷氨酰胺是血液循环中最丰富的氨基酸,代谢组学分析表明成骨前体细胞主要利用谷氨酰胺代谢来促进谷胱甘肽的生物合成。从而保护成骨分化关键转录因子RUNX2蛋白半胱氨酸残基不被氧化降解,进而促进成骨分化及骨形成。基于这一发现,抗氧化剂治疗增强了RUNX2蛋白的稳定性并显著改善了Runx2单倍体小鼠(人类罕见病颅骨发育不全模型)的骨骼发育(JCI Insight 2023)。
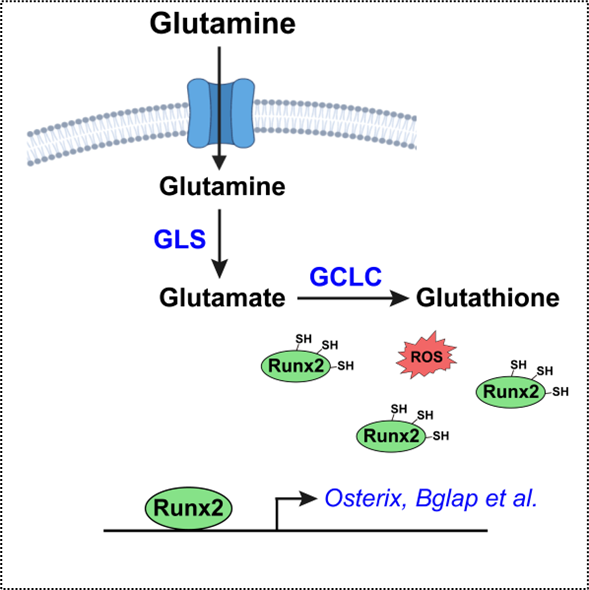
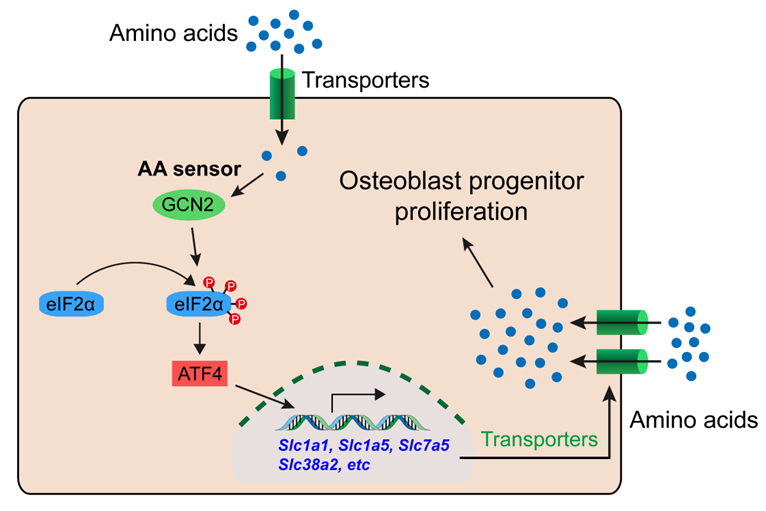
2. 氨基酸感知对骨稳态的调控作用:利用条件性基因敲除小鼠模型系统研究细胞内氨基酸浓度感受器GCN2及其下游eIF2a/ATF4通路对骨形成和骨吸收的重要调控作用。相关研究成果发表在美国骨矿研究学会权威期刊J Bone Miner Res等杂志。
代表性成果:研究发现 GCN2介导的氨基酸浓度感知信号通路通过两种不同的分子机制调控骨稳态:1) 通过维持ATF4依赖的氨基酸摄取来调节骨骼干细胞的增殖及骨形成(J Bone Miner Res 2020);2) 通过eIF2α/ATF4调控细胞自噬介导的NFATc1蛋白降解,进而调控RANKL的表达来控制破骨细胞分化及骨吸收。
代表性科研项目:
1. 2021.10-2022.09: Pharmacologically stimulating glutamine metabolism: a potential therapeutic strategy to rejuvenate bone. 美国德克萨斯大学西南医学中心Hamon再生医学中心专项基金,40万元,主持。
2. 2018.07-2020.06: Metabolic manipulation to promote bone regeneration. 美国杜克大学Regeneration Next专项基金,90万元,主持。
10篇代表性论文:
1. Hu G*, Whitaker A*, Zhang G, Karner CM. Divergent requirements for glutathione synthesis during osteoclast differentiation in vitro and in vivo. Antioxidants. 2025 Feb 10;14(2):197. doi: 10.3390/antiox14020197.
2. Hu G, Yu Y, Zhang G, Tower R, Karner CM. Glutaminolysis provides nucleotides and amino acids to regulate osteoclast differentiation and bone resorption in mice. EMBO Reports. 2024 Sep. https://doi.org/10.1038/s44319-024-00255-x.
3. Wei H, Weaver YM, Yang C, Zhang Y, Hu G, Karner CM, Sieber M, DeBerardinis RJ, Weaver BP. Proteolytic activation of fatty acid synthase signals pan-stress resolution. Nature Metabolism. 2024 Jan 2;6:113–126. https://doi.org/10.1038/s42255-023-00939-z.
4. Hu G, Yu Y, Sharma D, Pruett-Miller SM, Ren Y, Zhang G, Karner CM. Glutathione Limits RUNX2 Oxidation and Degradation to Regulate Bone Formation. JCI Insight. 2023 Aug 22;8(16):e166888.
5. Collins AT*, Hu G* (共同一作), Newman H, Reinsvold MH, Goldsmith MR, Twomey-Kozak JN, Leddy HA, Sharma D, Shen L, DeFrate LE, Karner CM. Obesity alters the collagen organization and mechanical properties of murine cartilage. Sci Rep. 2021 Jan 15;11(1):1626.
6. Hu G, Yu Y, Tang YJ, Wu C, Long F, Karner CM. The Amino Acid Sensor Eif2ak4/GCN2 Is Required for Proliferation of Osteoblast Progenitors in Mice. J Bone Miner Res. 2020 Oct;35(10):2004-2014.
7. Hu G*, Zhang N*, Li J, Wang J, Wu W, Li J, Tong W, Zhao X, Dai L, Zhang X. Tumor Necrosis Factor Receptor Associated Factor 3 Modulates Cartilage Degradation through Suppression of Interleukin 17 Signaling. Am J Pathol. 2020 Aug;190(8):1701-1712.
8. Yu Y, Newman H, Shen L, Sharma D, Hu G, Mirando AJ, Zhang H, Zhang G, Hilton MJ, Karner CM. Glutamine Metabolism Regulates Proliferation and Lineage Allocation in Skeletal Stem Cells. Cell Metabolism. 2019 Apr 2;29(4):966-978.e4.
9. Deng L*, Hu G* (共同一作), Jin L, Wang C, Niu H. Involvement of microRNA-23b in TNF-α-reduced BMSC osteogenic differentiation via targeting runx2. J Bone Miner Metab. 2018 Nov;36(6):648-660.
10. Hu G, Zhao X, Wang C, Geng Y, Zhao J, Xu J, Zuo B, Zhao C, Wang C, Zhang X. MicroRNA-145 attenuates TNF-α-driven cartilage matrix degradation in osteoarthritis via direct suppression of MKK4. Cell Death Dis. 2017 Oct 26;8(10):e3140.
