
研究员队伍
刘泽阳
邮箱:zeyangliu@bjmu.edu.cn
地址:北京市海淀区学院路38号
个人简介:
北京大学临床医学高等研究院助理教授/副研究员,细胞稳态与衰老性重大疾病北京研究中心PI。长期从事生物力学与免疫工程学交叉研究,重点关注机械力调控对免疫细胞命运决定与功能状态的作用机制。代表性工作包括:(1)提出并系统发展“机械力调控免疫细胞命运与功能”的研究范式,构建具有可调粘弹性的人造抗原呈递细胞平台。(2)开发体内免疫激活的功能材料与递送系统,构建可植入仿生抗原呈递支架,实现 CAR-NKT 等免疫细胞在肿瘤微环境中的持续激活与功能维持,推动“原位重编程+力学调控”的细胞治疗新策略。(3)构建动态水凝胶与多细胞微环境调控体系,系统研究力学微环境对免疫细胞与干细胞命运调控的作用机制,并在组织再生与功能性组织构建中取得系列进展。
刘泽阳博士是英国皇家化学会(RSC)、美国生物医学工程学会(BMES)及癌症免疫治疗学会(SITC)会员,担任Med-X期刊编委(Editorial Board Member)及多本国际期刊审稿人。研究团队与国内外多家高校及科研机构保持长期合作,并根据研究需要,支持研究生和博士后开展联合培养与国际交流。
科研与教育经历
2015–2018 名古屋大学 博士
2018–2020 清华大学 博士后
2020–2022 南方科技大学 研究助理教授
2022–2025 加州大学洛杉矶分校 助理项目研究员
2026–至今 北京大学临床医学高等研究院 助理教授/副研究员
主要研究方向:
主要从事生物力学与免疫工程学交叉研究,关注机械力如何调控免疫细胞的命运决定与功能状态(图 1)。
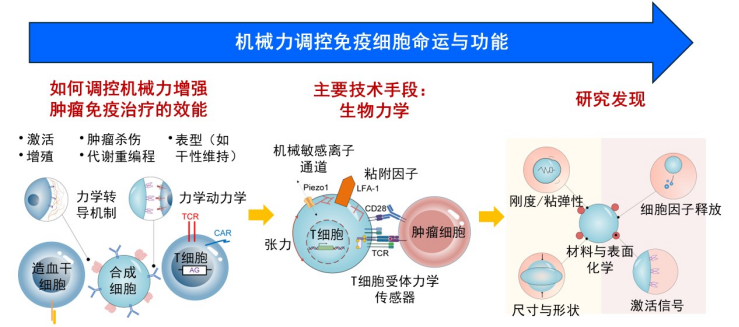
图1.研究体系与科研思路
1.可调粘弹性合成抗原呈递细胞增强TCR-T细胞激活与抗肿瘤效能
TCR-T细胞在实体瘤治疗中显示出高度特异性,但其在体外扩增效率、干性维持能力及代谢适应性仍存在显著不足。研究表明,T细胞激活不仅依赖抗原刺激强度,更受到其所处力学环境的显著影响,如粘弹性参数变化可影响细胞受体聚集、钙离子通道开启及下游磷酸化反应强度等。本项目将开发一种粘弹性可调的合成抗原呈递细胞(VxSCs),具备构建仿生力学环境与高密度受体激活阵列的能力(图2)。本项目将以TCR-T细胞(靶向NY-ESO-1)为模型,系统评估不同粘弹性输入对其代谢通路、表型谱系、克隆扩增与肿瘤杀伤活性的影响,并结合RNA-seq与代谢组学手段解析其内在机制。通过体外与类器官模型验证,建立“机械力调控TCR-T干性维持”策略,为提升TCR-T疗效提供工程化手段。
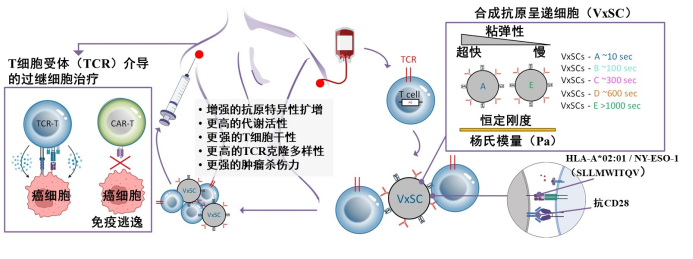
图2. 粘弹性调控合成抗原呈递细胞(VxSC)用于增强TCR-T细胞激活、干性维持与抗肿瘤功能
2. 集成多模调控机制的免疫支架增强CAR-NKT细胞局部应答与免疫逃逸逆转
实体瘤微环境常伴随免疫抑制、代谢抑制及细胞功能衰竭,严重限制CAR-NKT细胞的应答效率与持久性。本项目将开发具备抗原激活、力学刺激、代谢支持与检查点拮抗四重功能的可植入式免疫支架系统,以增强CAR-NKT细胞在肿瘤局部的激活深度与持续效能(图3)。支架表面协同修饰CD1d/α-GalCer与IL-15/IL-15Rα复合物,实现NKT细胞的特异性识别与增殖诱导;内部集成可调粘弹性模块,模拟天然抗原呈递细胞的机械微环境,提升细胞激活信号与干性谱系维持能力;同时嵌入微环境响应释放单元,在肿瘤局部高乳酸、低氧等条件下,选择性释放代谢激活剂(如AMPK激动剂)与PD-1/PD-L1拮抗因子(如小分子抑制剂或抗体片段),有效逆转免疫耗竭与肿瘤免疫逃逸。该系统将在人源实体瘤类器官与异种移植模型中验证其对CAR-NKT细胞浸润深度、功能持续性与肿瘤清除能力的提升效果。
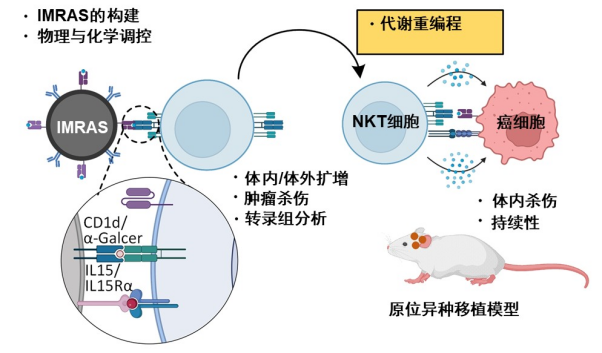
图3. 靶向NKT细胞的招募与激活系统(iMRAS)用于增强实体瘤微环境中的免疫应答
代表性科研项目:
机械力调控免疫细胞功能的作用机制研究
力学输入对细胞稳态与衰老相关过程的调控机制研究
基于力学调控的细胞肿瘤治疗工程化应用研究
10篇代表性论文:
1. Z. Liu*, G. Chen*, M. Jo*, V. Vogel, J. Chen, J. A. Rogers, S. Li. (2026). Mechanomedicine. Nature Reviews Bioengineering, https://doi.org/10.1038/s44222-025-00391-6.
2. Y.-R. Li*, H. Nan*, Z. Liu*, Y. Fang, Y. Zhu, Z. Lyu, Z. Shao, E. Zhu, B. Zhang, Y. Yang, X. Shen, Y. Chen, T. Hsiai, L. Yang, S. Li. (2025). Engineering an in vivo charging station for CAR-redirected invariant natural killer T cells to enhance cancer therapy. Nature Biomedical Engineering, In press.
3. Z. Liu*, Y.-R. Li*, Y. Yang*, E. Zhu, H. Nan, Y. Yan, B. Zhang, G. Chen, N. Pedroncelli, Z. Lyu, J. Lin, J. Soto, L. Yang, S. Li. (2025). Manufacturing Synthetic Viscoelastic Antigen-Presenting Cells for Immunotherapy. Nature Protocols. https://doi.org/10.1038/s41596-025-01265-2
4. Y.-R. Li*, Z. Liu*, E. Zhu. (2025). Biomaterials-Mimicking Immunological Synapses for Enhanced T-Cell Activation in CAR-T Therapy. Science Bulletin. https://doi.org/10.1016/j.scib.2025.04.041
5. Z. Liu*, Y. R. Li*, Y. Yang*, et al. (2024). Viscoelastic Synthetic Antigen-Presenting Cells for Augmenting the Potency of Cancer Therapies. Nature Biomedical Engineering, 8, 1615–1633.
6. E. Zhu*, Z. Liu*, Y.-R. L. (2025). Feeder-Free Advances in T Cell Development and Therapy. Cell Biomaterials, https://doi.org/10.1016/j.celbio.2025.100244.
7. Z. Liu*, Y.-R. Li*, Y. Yang*, X. Shen, E. Zhu, H. Nan, S. Wang, J. Lin, L. Yang, S. Li. (2025). Engineering Biomaterials for Next-Generation Cancer Immunotherapy: From Cell Manufacturing to In Vivo Modulation. Cell Biomaterials, Major revision.
8. G. Chen*, T. Chuang*, Z. Liu, et al. (2024). Hemodynamics-Driven Living Magnetoelastic Vascular Grafts. Nature Biotechnology, in press.
9. Z. Liu*, H. Nan*, Y. Chiou*, Z. Zhen, P. Lobie and C. Hu. (2022). Selective Formation of Osteogenic and Vasculogenic Tissues for Cartilage Regeneration. Advanced Healthcare Materials. (2022): 2202008.
10. Z. Liu*, H. Nan*, T. Xu, X. Gong and C. Hu. (2021). Programmable Electrodeposition of Janus Alginate/Poly-L-lysine/Alginate (APA) Microcapsules for High-resolution Cell Patterning and Compartmentation. Small, 2021 Dec 18:e2106363.
